甲状腺炎补硒和锌有用吗(锌炎补甲状腺硒用有副作用吗)

硒在细胞死亡中的作用
Peng-Ning Gao, Chuan-Lin Wang, Jia-Li Xu, Shan-LingLiu, Lan Zhou*
云南省肿瘤医院/昆明医科大学第三附属医院/云南省肿瘤中心临床营养科,昆明,650106
通讯作者:Lan Zhou ()
引用信息
Gao P-N, Wang C-L, Xu J-L, Liu S-L, Zhou L. Role of seleniumin cell death. J Nutr Oncol2023;8(2):94–100. doi: 10.1097/JN9.00009
点击此处下载原文 Role of selenium in cell death
文章摘要
硒是一种与体内氧化还原稳态密切相关的必需营养素。氧化还原失衡会对细胞内外的微环境产生不利影响,导致细胞死亡。近年来发现了各种类型的细胞死亡,但硒的作用和相关作用机制需要进一步阐明。本文综述了硒在细胞坏死、凋亡、铁死亡、自噬和焦亡中的作用及其机制。正常情况下,硒通过下调NF-κB通路,上调抗凋亡蛋白,降低氧化应激,增加抗氧化酶活性,增强mTOR通路,下调NLRP3/caspase-1通路,抑制细胞坏死、凋亡、铁死亡、自噬和焦亡,从而帮助维持细胞的正常生理功能。另一方面,硒缺乏激活PI3K/AKT和Notch/Hes1通路,机体氧化应激水平显著升高,导致细胞坏死、凋亡和焦亡。在恶性肿瘤中,无机硒的体内代谢物—硒化氢,其高氧化还原活性诱导肿瘤细胞凋亡和铁死亡,发挥抗肿瘤作用。总之,体内足够水平的硒对于维持正常的细胞生理功能和减少纤维化改变是必不可少的。此外,无机硒的体内代谢产物可能在抗肿瘤治疗中具有一定的临床价值。
关键词:细胞凋亡;自噬;细胞死亡;铁死亡;细胞坏死;氧化应激;细胞焦亡;硒
文章内容
引言
硒是人体必需的微量元素之一。它在体内发挥多种功能,如影响身体的氧化还原水平以确保甲状腺和生殖系统的正常功能,调节免疫细胞发挥抗炎作用,激活转录因子影响细胞生长相关的基因的表达。在人体中,硒主要以硒蛋白的形式发挥生理功能,如谷胱甘肽过氧化物酶(GPX)、碘甲状腺原氨酸脱碘酶和硫氧还蛋白还原酶。
细胞死亡是调节正常生长发育和维持体内平衡的重要过程,细胞死亡失调是导致癌症等多种疾病的重要原因。细胞死亡可分为两类:意外性细胞死亡(ACD)和程序性细胞死亡(PCD)。ACD指由极端的物理、化学或机械创伤引起的细胞死亡,典型形式是细胞坏死,它可能发生在感染性和非感染性疾病以及癌症中。相反,PCD是由基因调控引起的,在免疫、神经发育、癌症和感染等多个领域进行了研究。最早发现的PCD类型是细胞凋亡和自噬,最近又发现了铁死亡和焦亡等其他类型。
硒通过调节人体内的氧化还原平衡,对细胞生长和发育产生重大影响。图1显示了有机硒和无机硒对氧化还原平衡的影响。尽管已经有关于硒在细胞死亡中的作用的研究,但其在不同类型的细胞死亡中所起的具体作用尚不清楚。本文综述了硒及其代谢产物在细胞坏死、凋亡、铁死亡、自噬和焦亡中的作用,对硒及其代谢产物的生物学功能有更深入的了解,并提出了含硒小分子作为补充剂或候选药物的潜在治疗应用。

图1.无机硒和有机硒调控ROS生成的途径
硒与细胞坏死
坏死是一种不受控制、能量独立的细胞死亡形式,由突然休克引起细胞严重损伤。
细胞坏死机制
坏死过程通常涉及多种促炎蛋白和化合物的上调。其过程由RIP1和RIP3控制,包括TNF相关的凋亡诱导配体、Fas受体和TNFR1参与。
硒在细胞坏死中的作用
研究发现,硒通过NF-κB,NF-κB/IκB等通路调节细胞坏死,减少炎症。硒通常也是氧化应激的调节因子。硒还能够调节经典的细胞坏死途径,如HMGB1/NF-κB信号通路、PI3K/AKT信号通路以及ROS/MAPK信号通路。因此,硒通过下调NF-κB和氧化应激途径来抑制细胞坏死并减轻意外性细胞损伤。当硒缺乏时,PI3K/AKT通路过度活跃,导致细胞坏死和机体损伤。
硒与细胞凋亡
细胞凋亡是一种基因控制、自主、有序的细胞死亡形式,它需要激活含半胱氨酸的天冬氨酸特异性蛋白酶(caspases),诱导多种底物广泛裂解和细胞快速死亡。
细胞凋亡机制
细胞凋亡的激活有两种经典途径。外源途径依赖于同源结合配体对死亡受体的激活,而内源途径(也称为线粒体途径)依赖于细胞因子剥夺、DNA损伤或内质网应激等应激后线粒体外膜广泛渗透。许多蛋白质已被证明可以调节内源性凋亡途径,包括抗凋亡蛋白(BCL-2、BCL-XL、MCL-1、BCL-W和A1/BFL1)和与诱导细胞凋亡相关的蛋白(BAX和BAK)。
硒在肿瘤细胞凋亡中的作用
硒在正常和恶性细胞的凋亡中都起着重要作用。GPX2调节肠道细胞再生和凋亡之间的平衡,并抑制炎症诱导的肠道癌变。Nrf2的过度激活通过抑制细胞凋亡导致肿瘤过度生长,硒作用于Nrf2信号通路以抑制肿瘤发生。硒还通过抑制Nrf2/Prx1途径诱导细胞凋亡,减少肿瘤细胞中的药物解毒,并增加抗癌药物的细胞毒性作用。H2Se在肝细胞癌细胞中积累,破坏线粒体结构和功能,并通过线粒体途径诱导细胞凋亡。在乳腺癌细胞中,硒增加了caspase-3和caspase-9的表达,诱导细胞凋亡。硒和顺铂协同诱导细胞凋亡以杀死肿瘤细胞。
硒在正常细胞凋亡中的作用
硒通过诱导或抑制细胞凋亡来介导正常的细胞功能。临床研究发现补充硒酵母,通过下调血管内皮细胞和心肌细胞caspase-3活性、caspase-2和Bax表达,并刺激Bcl-2表达,从而抑制细胞凋亡,预防动脉粥样硬化。硒甲硫胺酸可以影响凋亡相关基因(Bcl-2、Bax、Cyt-c、caspase-3和caspase-9)的表达,以改善心肌损伤。硒及其代谢产物对生殖和骨骼肌系统至关重要,对人类正常发育至关重要。轻度硒缺乏会影响精子的活力和形状,而严重硒缺乏则会阻止精子发生。硒可能通过调节GPX4的表达来促进细胞增殖。硒是骨骼健康的必需营养素,其作用可能与维持氧化还原细胞稳态、保护骨骼免受氧化应激和特异性硒蛋白有关,这些硒蛋白已被证明可调节成骨细胞增殖和分化。
总之,硒通过上调抗凋亡蛋白和GSH-Px来保护正常细胞免于凋亡。在肿瘤细胞中,硒通过抑制经典氧化应激途径中基因的表达和激活凋亡相关基因来诱导细胞凋亡,从而发挥抗肿瘤作用。
硒与铁死亡
铁死亡是一种由铁离子依赖性脂质过氧化引起的ROS大量积累导致细胞死亡。铁死亡的病理变化与坏死、细胞凋亡和自噬不同,形态上表现为线粒体收缩、细胞质和细胞器肿胀、质膜破裂和形成双膜囊泡。在分子生物学方面,铁死亡表现为GPX4水平和谷氨酸-胱氨酸反向转运系统(System Xc−)活性显著降低。
铁死亡的机制
GPX4是一种硒蛋白,可将有毒的脂质过氧化物转化为无毒的脂质醇。SystemXc−是细胞膜中重要的抗氧化成分,由轻链(SLC7A11)和重链(SLC3A2)组成。SLC7A11轻链负责胱氨酸的转移以合成GSH,而SLC3A2作为伴侣维持SLC7A11的稳定性和膜定位。System Xc−活性降低影响细胞内胱氨酸摄取,导致细胞内GSH耗竭和GPX4活性降低,氧化损伤和铁死亡增加。
硒在铁死亡中的作用
硒化氢是在亚硒酸钠的代谢过程中产生的。在生理pH下,几乎所有的硒化氢都是HSe−形式,具有最高的氧化还原活性,可以产生大量的ROS。肿瘤细胞中ROS的浓度约为正常细胞的100倍,当肿瘤细胞暴露于亚硒酸钠时,细胞增殖受到抑制,脂质过氧化显著增加,细胞形态发生变化,并发生显著的铁死亡。GPX4和SLC7A11都降低了细胞内GSH含量,从而诱导细胞中的铁死亡,特别是那些处于氧化应激下的细胞。硒增加细胞ROS水平和降低GSH含量的机制如图1所示。硒还可以通过经典的氧化途径诱导铁死亡,高剂量补硒可以下调经典的抗氧化途径,诱导铁死亡样变化,并抑制癌症细胞的增殖。
硒介导的铁死亡与纤维化的发展有关
肺纤维化是常见的炎症性肺部疾病,但目前尚无有效的临床药物治疗。多项研究结果表明,铁死亡与肺纤维化、肝纤维化关系密切。这些研究发现,硒作为一种营养物质,可以抑制各种器官的纤维化变化,可能与其对细胞内氧化应激的影响有关。目前还需要更多实验来验证硒和铁死亡之间的关系,以及硒保护全身各器官免受因铁死亡而发生纤维化的能力。
总之,硒通过调节GPX4含量和SLC7A11表达以及降低细胞内氧化应激状态来抑制铁死亡。在肿瘤细胞中,亚硒酸钠的代谢产物HSe−由于其高氧化还原活性,通过诱导铁死亡促进肿瘤细胞死亡。硒还可以通过抑制铁死亡来防止各种器官的纤维化变化。
硒与自噬
自噬是一种高度保守的生物学现象,在这种现象中,真核细胞通过溶酶体降解其受损的细胞器和蛋白质,为其能量循环提供氨基酸、游离脂肪酸和其他物质,从而适应缺氧和饥饿。自噬有四个基本过程:诱导、自噬体生物发生、自噬溶酶体形成和自噬降解。在生理正常或营养缺乏的条件下,自噬是维持细胞正常生理功能的保护机制。然而,过度的自噬会促进细胞损伤,导致自噬性细胞死亡。这些研究证据可以在癌症治疗中加以利用。
自噬的机制
自噬需要各种自噬相关基因(ATGs)和蛋白质的严格调控。此外,自噬受多种信号通路的调节。例如,ULK1复合物调节自噬的启动。AMPK通过mTOR调节自噬。LC3是哺乳动物细胞中ATG8的同源物,LC3-II的量与自噬体的数量成比例,可以用作自噬体形成程度的有用指标。
硒在自噬中的作用
硒对自噬的影响可以通过多种途径介导。硒最重要的功能之一是调节细胞内ROS水平。研究发现,硒代蛋氨酸可以通过经典的Keap1/Nrf2氧化应激途径减少自噬。锌和硒代蛋氨酸的组合降低了ROS水平,以防止自噬并减轻天花粉蛋白A的肾毒性。当硒缺乏时,小鼠肝脏线粒体会发生自噬,导致肝脏损伤和纤维化。当硒纳米颗粒用作补充剂时,小鼠肝脏中的mTOR信号通路上调,抑制自噬并保护肝脏。硒还通过调节PI3K/AKT/mTOR通路和减弱炎症细胞因子的分泌发挥抗炎作用,从而减少自噬和炎症。硒纳米颗粒的给药通过mTOR途径显著抑制自噬,以减轻庆大霉素引起的肾损伤。
总之,硒通过维持细胞氧化稳态和增强PI3K/AKT/mTOR途径来抑制某些药物的毒性,从而抑制细胞自噬发生。因此,硒可能通过抑制自噬途径起到保护剂或解毒剂的作用。
硒与焦亡
焦亡是最近发现的PCD的一种形式。它表现为细胞的持续扩张,直到细胞膜破裂,导致细胞内容物的释放和强烈炎症反应的激活。焦亡是自然免疫反应的重要组成部分,介导抗感染过程并传递内源性危险信号。焦亡失调与神经问题和动脉粥样硬化疾病有关。
焦亡的机制
焦亡可分为caspase-1依赖性和其他caspase依赖性途径。Caspase-1依赖性信号通路也是经典的炎性囊泡信号通路。病原体相关分子模式或宿主衍生的危险信号分子激活相应的模式识别受体。活化的炎症小体募集炎症小体连接蛋白ASC和caspase-1形成大分子复合物。Caspase-1直接切割gasdermin D(GSDMD)以启动细胞焦亡。此外,caspase-1切割pro-IL-1β和pro-IL-18前体,将其转化为成熟的、具有功能性的IL-1β和IL-18蛋白。裂解的GSDMD N-末端片段在宿主细胞膜中形成孔,以调节细胞质内容物的释放。
Caspase 4/5(小鼠caspase-11)依赖性信号通路也被称为非经典炎性囊泡信号通路。由人源性的caspase-4和caspase-5或鼠源性caspase-11触发的。这些炎性caspases直接裂解GSDMD并引发细胞焦亡。GSDMD切割的N-末端片段可以激活具有成熟的Caspase-1依赖性IL-1β和IL-18的NLRP3炎性囊泡。
硒在焦亡中的作用
硒作为抗氧化防御的重要组成部分,在心血管健康中起着至关重要的作用。在一项横断面研究中,补充亚硒酸钠或富硒酵母可能通过影响细胞焦亡来降低动脉粥样硬化患者的炎症反应。硒蛋白缺乏小鼠的氧化应激显著增加,这导致经典信号通路过度激活,细胞焦亡显著增加。硒主要介导参与细胞焦亡发生发展的经典信号通路。硒相关的植物复合物调节参与巨噬细胞焦亡的NLRP3/caspase-1通路。
硒与细胞焦亡密切相关,通过下调NLRP3/caspase-1信号通路来保护细胞。当硒缺乏时,体内的氧化应激会升高,导致细胞焦亡显著增加,并对机体造成严重损害。
结论
在正常条件下,硒通过下调NF-κB和氧化应激途径抑制坏死并减轻细胞损伤。硒还通过上调抗凋亡蛋白和GSH-Px、提高GPX4含量和SLC7A11表达、减少细胞内氧化应激、增强PI3K/AKT/mTOR信号传导、下调NLRP3/caspase-1途径以及各种其他机制,保护正常细胞免受凋亡、铁死亡、自噬和焦亡的影响,从而维持细胞中的正常生理功能。
在硒缺乏的情况下,PI3K/AKT通路和Notch/Hes1通路被激活,氧化应激水平显著升高,导致细胞坏死、细胞过度凋亡,细胞焦亡显著增加,对身体造成严重损伤。硒参与细胞死亡的分子机制如图2所示。
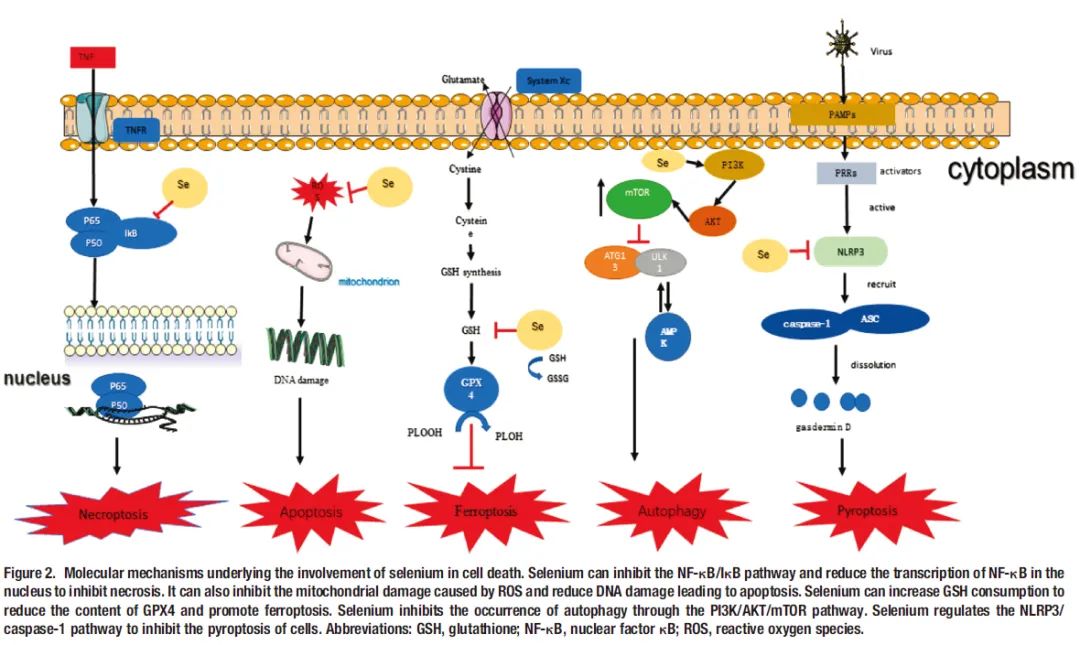
图2. 硒参与细死亡的分子机制
对于硒在正常细胞和肿瘤细胞中的不同作用,有两种解释:(1)肿瘤细胞通常表现为氧化应激,因此肿瘤细胞中的ROS和GSH浓度通常比正常细胞高得多。ROS可以通过多种信号通路参与肿瘤细胞的死亡或发展,其中许多是由硒蛋白调节的;(2)肿瘤细胞具有“亲硒性”。肿瘤细胞利用酶和非酶抗氧化剂来帮助其氧化分子解毒,而硒是这些解毒剂的原材料。肿瘤细胞的“亲硒性”可能是其独特的弱点,使其能够优先成为细胞死亡的靶点。
总之,硒作为一种必需营养素,通过多种途径调节多种细胞死亡模式,在生理和病理状态下发挥着重要作用。调节体内硒的含量可能有助于维持正常的细胞生理功能,减少纤维化改变,确保正常的免疫反应。无机硒的体内活性代谢产物HSe−在抗肿瘤治疗中可能具有一定的临床意义。
翻译:莫思思/广西医科大学第一附属医院JNO编辑部
审校:宋春花/郑州大学公共卫生学院流行病学系
杂志主编

石汉平
首都医科大学附属北京世纪坛医院胃肠外科主任、临床营养科主任

陈俊强
广西医科大学副校长
广西医科大学第一附属医院院长
联系我们:
Email:
期刊官网:
欢迎投稿:


往期回顾
继续阅读
- 暂无推荐

