查微量元素怎么查(查微量元素需要空腹抽血吗)

你知道吗?硅元素,这个闪闪发光的元素,虽然可能不如黄金或银贵重,但它却扮演着无可替代的角色。当我们想到硅,很可能首先联想到的是硅谷,科技创新,或是我们日常生活中无处不在的电子设备。然而,硅的魅力远不止于此。它是地壳中第二丰富的元素,同时也是我们的星球上最丰富的几种元素之一。硅的多面性使得它成为材料科学和电子工业中的瑰宝,而它在自然界的丰富存在则是地球生态系统的关键组成部分之一。让我们一起深入探索硅元素的神奇世界,了解它是如何塑造我们的现实,以及它未来的无限潜力。

硅元素的应用领域
1. 半导体电子工业:
– 硅在半导体制造中起到核心作用,用于制造集成电路(IC)和其他电子元件。硅晶片上的微细电路和晶体管构成了计算机、手机、平板电脑、电视等各种电子设备的核心部分。
2. 光伏能源:
– 硅是太阳能电池的主要材料之一。光伏电池利用太阳光转化为电能,为可再生能源产业做出了巨大贡献,用于发电、电池储能系统等。
3. 材料科学:
– 硅被广泛用于制造高温和高强度的材料,如硅钢、硅铝合金,用于制造汽车引擎和航天器件中的结构材料。
4. 光学和光纤通信:
– 硅具有优异的光学特性,用于制造光学镜片、光学纤维和激光器件,支持高速通信和激光技术的发展。
5. 建筑和建筑材料:
– 硅被用于制造玻璃、水泥、混凝土、瓷砖等建筑材料,同时也用于防水和绝缘材料的生产。
6. 医疗领域:
– 硅在医疗器械制造中广泛应用,包括人工关节、牙科材料、药物传递系统等。
7. 化学工业:
– 有机硅化合物,如硅橡胶、硅油等,在制药、化妆品、润滑剂等领域中有广泛应用。
8. 农业:
– 硅肥料用于提高植物的抗病性和生长能力,有助于提高农作物的产量。
9. 航空航天:
– 硅在航空航天领域用于制造航天器件、热屏蔽材料和轻质结构组件。
硅元素具有广泛的应用领域,对现代社会和科技的发展起到了至关重要的作用。无论是在电子、能源、建筑、医疗、化工还是农业等领域,硅都是不可或缺的材料之一。它的多功能性和稳定性使得它在各个领域都有着不可替代的地位。

硅元素的物理性质
硅元素(符号:Si)是一种非金属元素,具有丰富的物理性质,以下是对其物理性质的详细介绍:
1. 颜色和外观:硅以不同形式存在。晶体硅呈钢灰色,有金属光泽,呈固体晶体结构;而无定形硅通常为黑色,没有明显的晶体结构。
2. 密度:硅的密度约为2.32至2.34克/立方厘米,具体数值取决于硅的晶体形态。
3. 熔点和沸点:硅的熔点相对较高,约为1414摄氏度(2577华氏度)。其沸点更高,约为2900摄氏度(5252华氏度)。
4. 晶体结构:硅以晶体形式存在,其晶体结构类似于金刚石,采用立方晶格结构。这使得硅在半导体制造中具有特殊的电子性质。
5. 硬度:硅是一种相对硬的材料,通常具有较高的摩氏硬度,约为7(在1到10的硬度刻度上)。
6. 电导率:硅是一种半导体材料,室温下的电导率相对较低。其本征载流子浓度约为1.5×10^15/cm^3,但可以通过掺杂来改变其导电性能,使其用于半导体器件制造。
7. 热膨胀系数:硅的线性热膨胀系数相对较低,这使得它在高温下具有较好的稳定性。
8. 热性能:硅在高温下表现出较好的稳定性,因此在高温环境中广泛应用,如在电子器件中。
9. 光学性质:硅具有良好的透明性,尤其在红外光谱范围内,因此用于制造光学器件和红外窗口。
10. 热导率:硅在室温下具有相对较高的热导率,这使其在散热应用中非常有用。
硅元素的物理性质使其成为多个领域的重要材料,特别是在电子、光伏、建筑、光学和高温应用等方面。其半导体性质和稳定性使其在现代技术和工业中发挥了重要作用。

硅元素的化学性质
硅元素(符号:Si)的化学性质包括其反应性、化学键形成、化合物形成等方面,以下是对硅元素的化学性质的详细介绍:
1. 反应性:硅在常温下对大多数常见气体相对不活泼,但在高温下能与许多元素和化合物发生反应。主要的反应包括与氧气、氮气、氢气和卤素等元素的反应。
2. 氧化性:硅能够与氧气反应形成氧化硅(SiO2),这是硅最常见的氧化物,也被称为二氧化硅。硅的氧化物在自然界中广泛存在,形成了硅酸盐矿物的主要组成部分。
3. 与氢的反应:硅能够与氢气反应形成硅化氢化合物,如硅烷(silane)系列化合物。硅烷化合物在半导体工业中用于表面处理和薄膜沉积。
4. 与卤素的反应:硅可以与卤素如氯、溴和碘反应形成卤化硅化合物,例如硅四卤化物(SiX4,其中X为卤素)。这些化合物在有机合成和材料制备中具有重要作用。
5. 与碱金属的反应:硅和碱金属(如钠和钾)可以发生反应,形成硅化合物,如硅化钠(Na2Si)和硅化钾(K4Si)等。
6. 与酸的反应:硅一般不溶于酸,包括硫酸和盐酸。然而,在氢氟酸(HF)中,硅会发生剧烈的反应,产生气体氟化氢(HF)和硅的水合氟化物。
7. 与水的反应:硅在常温下不与水反应,但在高温下能够与水蒸气发生反应,生成二氧化硅和氢气。
8. 与非金属元素的反应:硅与一些非金属元素如碳和氮能够形成碳化硅(SiC)和氮化硅(Si3N4)等化合物。这些化合物在陶瓷和高温材料领域有广泛应用。
硅元素的化学性质相对活泼,尤其是在高温条件下。它能与氧气、氢气、卤素和非金属元素形成多种化合物,这些化合物在电子、半导体、材料科学、化学工业和其他领域中具有广泛应用。硅也是地壳中丰富的元素之一,其化学性质在自然界中起着重要作用。

硅元素的生物特性
硅元素在生物体系中一般不被认为是生命的基本构成要素,而是以碳、氢、氮、氧、磷、硫(C, H, N, O, P, S)为基本元素的有机生物体系。硅并非生命体系所必需,但是在一些生物体内或周围存在微量的硅,并可能对生物体产生影响。
以下是对硅在生物体系中的一些特性的简要介绍:
1. 微量元素:硅是一种微量元素,存在于许多植物、动物和微生物中,但浓度相对较低。一些植物,如硅植物(如稻米、小麦、矽藻等),能够吸收和利用土壤中的硅。
2. 对植物的影响:硅对植物生长有积极影响。它可以增强植物细胞壁的强度和稳定性,提高植物的抗病虫害能力,促进植物的生长和发育。
3. 硅化物:一些海洋生物,如硅藻和硅海绵,能够吸收水中的硅,将其转化为硅化物,形成他们的骨骼、外壳或支架结构。硅海绵的身体结构就主要由硅骨架构成。
4. 硅与脊椎动物:硅并非脊椎动物的生命体系的基本成分,脊椎动物体内一般不含硅骨架。但是,一些海洋生物可能通过食物链摄取了微量的硅。
总体来说,硅在生物体系中主要以微量元素的形式存在,对植物和一些海洋生物有一定影响。然而,硅不是构成生物体系基本要素,生命体系的基本组成要素是以碳为基础的有机分子。

硅元素的自然分布
硅元素在自然界中广泛分布,是地壳中丰富的元素之一。以下是对硅元素在自然界中的分布状况的详细介绍:
1. 地壳中的丰度:硅是地壳中第二丰富的元素,仅次于氧。地壳中硅的丰度约占地壳总质量的约27.7%,或称之为地壳中含量的百分之二十八左右。这使硅成为地球壳的主要构成元素之一。
2. 硅矿物:硅主要以氧化物的形式存在于自然界中,最常见的硅矿物是二氧化硅(SiO2),也被称为石英。除了石英,其他含硅的矿物包括水晶、玛瑙、紫晶、翡翠、岩石中的玄武岩、花岗岩等。这些硅矿物在地壳中广泛分布,可以在各种岩石和矿物中找到。
3. 硅酸盐矿物:硅也以硅酸盐矿物的形式存在。硅酸盐矿物包括长石、角闪石、云母等,它们在岩石和矿物中起到重要的构造和矿床形成作用。
4. 硅的循环:硅在地球上经历了不断的循环过程,包括岩石的风化和侵蚀、水体中的溶解和沉淀、硅藻和硅海绵的生物作用等。硅的循环过程有助于维持地球的生态平衡,并影响到海洋生态系统的健康。
5. 海洋中的硅:硅在海水中以硅酸盐的形式存在,是海水中的重要成分之一。硅酸盐在海洋中起到重要的生态角色,是硅藻等浮游植物的生长所需。
硅元素在自然界中广泛分布,主要以硅矿物和硅酸盐的形式存在于地壳和水体中。它在地质、生态和地球化学过程中发挥着重要作用,并对地球的自然环境和生物圈起着关键作用。

硅元素的开采提取及冶炼
硅元素的开采和提炼过程通常包括以下主要步骤,以下是详细介绍:
1. 硅矿采矿:硅主要以硅酸盐矿物的形式存在于自然界中。最常见的硅矿是石英(二氧化硅,SiO2)。硅矿通常位于地下或地表,因此首先需要进行硅矿的采矿。采矿可以通过地下或露天采矿方法进行。
2. 矿石破碎:采矿后,硅矿石被送往矿石破碎工厂进行破碎。这一步骤的目的是将硅矿石破碎成更小的颗粒,以便后续的处理。
3. 矿石磨矿:破碎后的硅矿石通常需要经过磨矿,以将其细化成更小的颗粒,并去除掉杂质。
4. 浸出:接下来,经过磨矿的硅矿石通常需要进行浸出。这一步骤涉及使用化学方法,通常是用碱性或酸性溶液,以将硅酸盐中的硅分离出来。硅酸盐矿物通常与其他矿物杂质混合在一起,因此浸出过程可以帮助分离硅。
5. 硅的还原:分离出来的硅酸盐溶液中包含硅,需要进一步处理以将硅从硅酸盐还原成纯硅。这通常通过高温还原的方法进行,其中矿石与碳(通常是焦炭或木炭)一起加热至高温,使硅从硅酸盐中分离出来。化学反应如下:
[ text{SiO2} + 2text{C} rightarrow text{Si} + 2text{CO} ]
这一步骤产生了纯度较高的硅,但通常还需要进一步提纯。
6. 硅的提纯:为了获得高纯度的硅,通常需要进行多次提纯过程。其中一种常见的方法是使用化学气相沉积(CVD)或其他物理和化学方法,以去除残留的杂质,将硅的纯度提高到所需的水平。这可以达到半导体和电子行业的要求,其中需要极高纯度的硅。
7. 晶体生长:对于一些应用,如单晶硅用于半导体制造,还需要将硅进行晶体生长,以获得单一晶体的硅材料。这通常通过Czochralski法或浮区法等方法来实现。
硅元素的开采和提炼过程包括采矿、矿石处理、浸出、还原、提纯和晶体生长等多个步骤,以生产出不同纯度和形态的硅材料,以满足各种工业和科技应用的需求。

硅元素的检测方法
硅元素的常用检测方法主要包括原子吸收光谱法(AAS)、电感耦合等离子体质谱法(ICP-MS)、X射线荧光光谱法(XRF)、原子荧光光谱法(AFS)等。
硅元素的常用检测方法包括化学分析、光谱分析、质谱分析和仪器分析等多种技术。以下是这些方法的详细介绍:
1. 化学分析:
-重量法:这是最传统的检测方法之一。样品中的硅通过化学反应转化为硅酸盐,并用浓硫酸和氢氟酸消解,然后通过沉淀法、滴定法或光度法测定硅的含量。
-显微镜观察:这种方法适用于测定硅含量很高的样品,如矿石。样品经过化学处理后,在显微镜下观察硅矿物的特征形态,从而确定硅含量。
2. 紫外-可见分光光度法(UV-Vis)**:UV-Vis分光光度法可以用于测定硅酸盐中硅的含量。硅酸盐中的硅可以在特定波长下吸收或散射光,通过测量吸光度或散射光强度来确定硅含量。
3. 原子吸收光谱法(AAS):AAS是一种常用的定量分析方法,适用于测定溶液中的硅含量。该方法基于样品中目标元素吸收特定波长的光线时的吸收现象。首先,通过气体燃烧、高温干燥等预处理步骤将样品转化为可测量的形式。然后,向样品中通入与目标元素波长相对应的光线,测量样品吸收的光强度,并与已知浓度的硅标准溶液进行比较来计算样品中硅的含量。
4. 电感耦合等离子体质谱法(ICP-MS):ICP-MS是一种高灵敏度的分析技术,适用于测定液体和固体样品中的硅含量。该方法将样品转化为带电粒子,然后使用质谱仪进行质量分析。ICP-MS具有广泛的检测范围和高分辨率,可以同时测定多个元素的含量。对于硅元素的检测,ICP-MS能够提供非常低的检测限和较高的准确性。
5. X射线荧光光谱法(XRF):XRF是一种非破坏性的分析方法,适用于固体和液体样品中的硅含量测定。该方法通过照射样品表面产生的X射线,测量样品中荧光光谱的特征峰强度来确定其中的元素含量。XRF具有速度快、操作简便的优点,并且能够同时测定多个元素。然而,XRF在低含量硅的分析中可能受到干扰而导致误差较大。
电感耦合等离子体发射光谱法(ICP-OES):电感耦合等离子体发射光谱法是一种高灵敏度和高选择性的分析方法,广泛用于多元素分析。它通过将样品雾化并形成等离子体,在光谱仪器中测定铌元素发射的特定波长和强度。
这些方法的选择取决于样品类型、硅含量、所需精度和分析速度等因素。在实际应用中,可以根据需要选择合适的检测方法来测定硅元素的含量。对于高纯度硅材料的检测,通常需要更精确和灵敏的方法,如质谱法。而在一般化学分析和工业应用中,化学分析和光谱分析常常是常用的方法。

硅原子吸收法具体应用
在元素测量中,原子吸收法具有较高的准确性和灵敏度,为研究元素的化学性质、化合物组成以及含量提供了有效的手段。
接下来,我们使用原子吸收法来测量硅元素的含量。具体的步骤如下:
制备待测样品。将需要测量的样品制备成溶液,一般需要使用混酸进行消解,以便于后续的测量。
选择合适的原子吸收光谱仪。根据待测样品的性质和需要测量的硅元素含量范围,选择合适的原子吸收光谱仪。
调整原子吸收光谱仪的参数。根据待测元素和仪器型号,调整原子吸收光谱仪的参数,包括光源、原子化器、检测器等。
测量硅元素的吸光度。将待测样品放入原子化器中,通过光源发射特定波长的光辐射,待测硅元素会吸收这些光辐射,产生能级跃迁。通过检测器测量硅元素的吸光度。
计算硅元素的含量。根据吸光度和标准曲线,计算出硅元素的含量。
以下是一款仪器测量硅元素用到的具体参数。

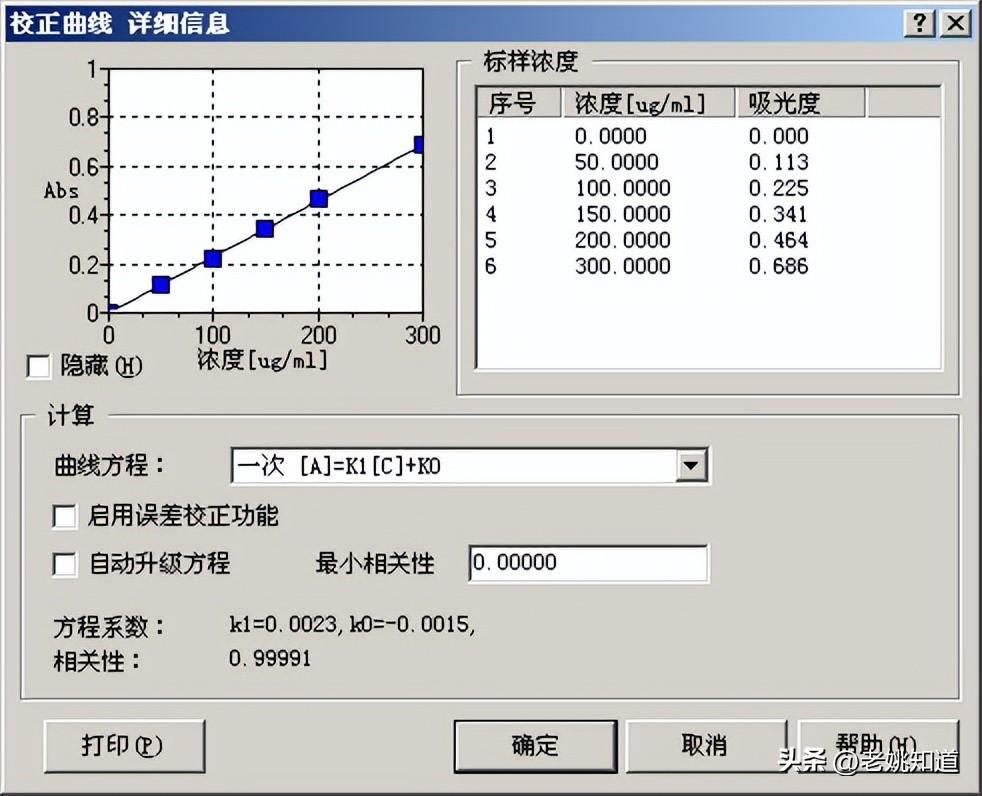
硅(Si)
标准物:优级纯Na2SiO3•9H2O(99.99%)。
方法:准确称取25.30gNa2SiO3•9H2O,溶于约300mL水中,用稀HCl中和至中性,用水准确定容至500mL,此溶液Si的浓度为5000μg/mL。避光保存于聚乙烯瓶中。
火焰类型:笑气-乙炔,富燃焰。
分析参数:
波长(nm) 251.6
光谱带宽(nm) 0.2
滤波系数 0.3
推荐灯电流(mA) 8
负高压(v) 398.75
燃烧头高度(mm) 10
积分时间(S) 1
空气压力及流量(MP,mL/min) 0.25,6000
笑气压力及流量(MP,mL/min) 0.22,5500
乙炔压力及流量(MP,mL/min) 0.1,6000
线性相关系数 0.99991
特征浓度(μg/mL) 0.0023
计算方式 连续法
溶液酸度 0.5% HNO3
测了表格:
序号
测量对象
样品编号
Abs
浓度
SD
RSD[%]
标准样品
Si1
-0.000
0.0000
0.0004
-110.5022
标准样品
Si2
0.113
50.0000
0.0029
2.5451
标准样品
Si3
0.225
100.0000
0.0047
2.0779
标准样品
Si4
0.341
150.0000
0.0061
1.7949
标准样品
Si5
0.464
200.0000
0.0047
1.0135
标准样品
Si6
0.686
300.0000
0.0166
2.4233
校准曲线:
干扰:
使用强富燃的笑气-乙炔火焰具有最高灵敏度,但积炭十分严重,应随时刮去燃烧头上的积炭。据报道,HF、H3BO3及大量的K+会抑止Si的吸收信号。应仔细调节乙炔的流量使火焰接近贫燃状态就会减小干扰,但灵敏度也会降低。
可加入2000μg/mL的Na来降低Si的电离。
实际工作中需要根据现场具体需要选择适合的测量方法。这些方法在实验室和工业中广泛应用于硅元素的分析和检测。