锌元素的化合价(锌元素化合价是几价)





2023-2024学年
新初三化学沪教版
暑假自学课
预习巩固
16个专题含解析
教师版+学生版
完整版可下载打印
所有文档word版
无水印、可编辑、可修改
完版目录及部分内容截图如下
下载方式见文末
















第16讲 化学方程式的书写与应用
1.通过具体化学反应分析,理解化学方程式的含义;了解书写化学方程式应遵守的原则;能正确书写简单的化学方程式。
2.在正确书写化学方程式的基础上进行简单的计算。
3.认识化学计算对于解决实际问题的重要意义,进一步了解化学定量研究的实际应用。
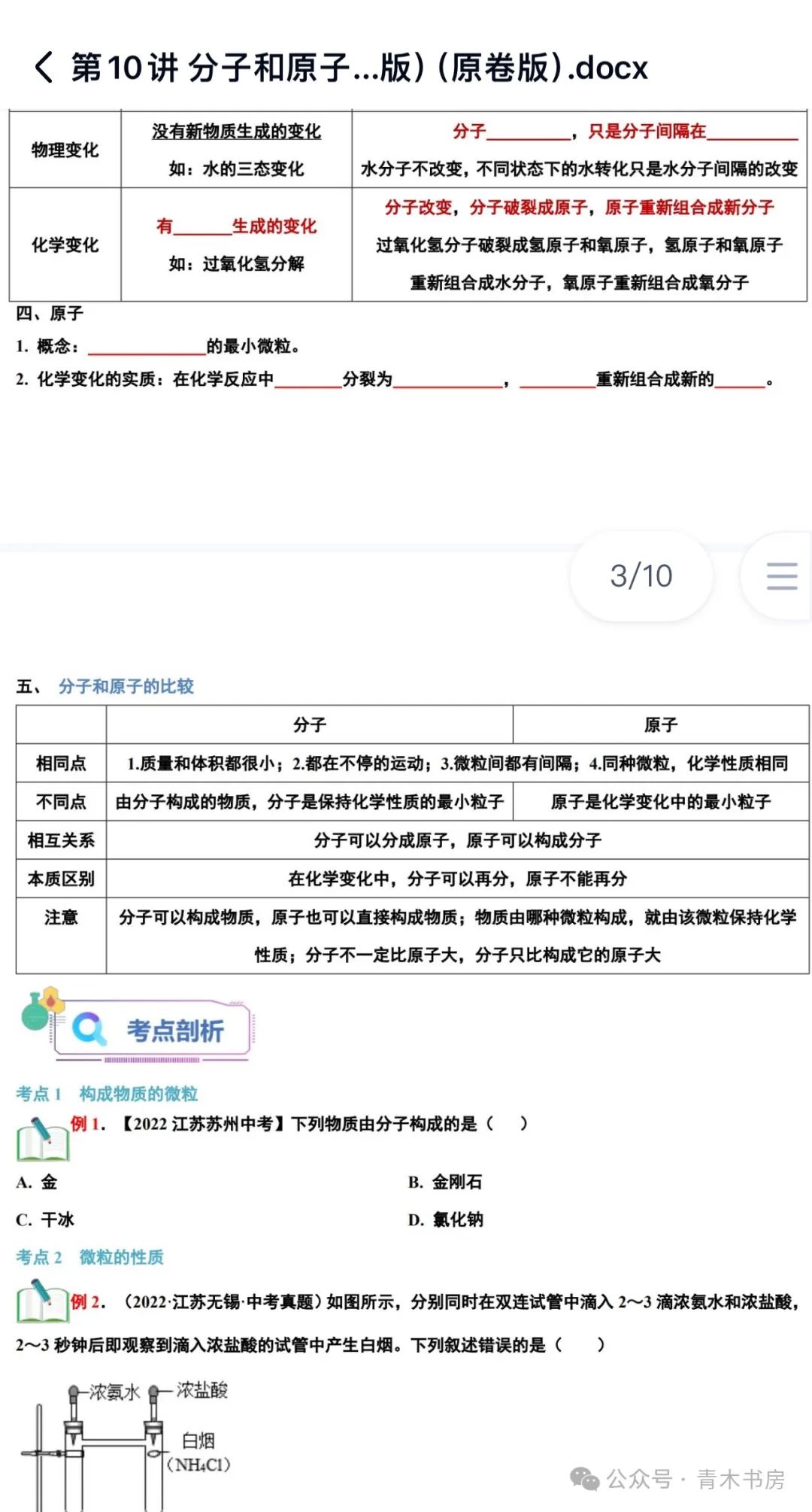
一、化学方程式的书写
对于化学方程式的书写,可以联系质量守恒定律、元素符号和化学式的书写及其意义、化学方程式的配平、常见物质的状态等相关知识细心地进行书写。书写化学方程式的步骤可以简记为“写、配、标、查”四个字。
化学方程式的配平方法:
⑴奇数配偶法:遇到等号两边某原子个数为3、5、7等奇数跟2、4、6等偶数进行配平时,则需寻找奇数与偶数的“最小公倍数”,即将奇数配偶,以此法将该原子配平。
2Fe2O3+3C===== 4Fe+3CO2↑
⑵观察法:遇到数字比较小的原子数,用眼睛看将各原子找等配平即可。
3H2+ WO3== W+3H2O
⑶有关CO还原的配平方法:1个CO夺取1个O变成1个CO2。且CO和CO2前面的化学计量数必须相等,否则碳原子个数不等,即:一个CO只能夺取一个O,所以金属氧化物中有多少个O,就需“派遣对应个数的CO去夺”。
Fe2O3+3CO==== 2Fe+3CO2
⑷单质特殊配平法:若方程式的等号两边出现多种物质时,观察时比较乱。若其中有单质出现,则应将单质的原子配平放在最后,先将其他原子的个数找等配平,然后在单质前面用分数找平,最后等号两边扩大相同倍数消掉分母,此法应在演草纸上进行,再将答案写到答题卡上。
C21H30O2+O2═══21CO2+15H2O 2C21H30O2+55O2═══42CO2+30H2O
二、化学方程式的计算
(1)根据化学反应方程式的计算的审题是非常关键的,一般是抓住“三找”;即一找化学反应方程式,二找已知量和未知量x,三找用到的相对质量关系。
(2)根据化学反应方程式的计算步骤和格式,一般可以简记为:“六步七行”。其中的“六步”,又可以对应着简记为:“设、方、质(分为相对质量和实际质量两行)、比、算、答”。
(3)根据化学反应方程式计算的过程中,一定要注意:①设未知量x时,x的后面不要带单位;②书写化学方程式的时候,切记严格地按照“写→配→标→注”步骤细心书写;③找质量关系时,最好先找下一行的实际质量关系(即已知量和未知量),然后再对应着找上一行的相对质量关系切记将它们都写在相应的化学式的正下方,分居上下两行。④列比例式时,要按照“上一行的相对质量比等于下一行的实际质量比”的顺序来列;保证是对应比相等。⑤求算x时,可以参考着化学方程式下面的两行质量关系中的上下或左右的倍数关系来求算。当没有倍数关系时,再按照一般的方法来求算便是。⑥在写答案时,只需要简明扼要地答出关键语句即可。
注意:
①若涉及物质的体积,则可利用公式m=ρV进行换算。
②代入方程式计算的必须是纯净物的质量,纯净物质量=混合物质量×该物质的纯度。
③代入方程式计算的必须是真正参加反应或反应后生成的纯净物质量。
总结:
(1)依据:质量守恒定律。
(2)步骤
①设:根据题意,设未知量为x(不带单位)。
②写:正确书写相关的化学方程式(一定要配平)。
③找:找出相关物质的化学计量数与相对分子质量的乘积以及已知量、未知量。
④列:列出比例式,求出未知量x(包含单位)。
⑤答:简明地写出答案。
常见类型
(1)有关纯净物的化学方程式的计算。化学方程式所表示的反应物和生成物都是纯净物的质量关系,可直接将已知纯净物的质量代入计算。
(2)遇到含杂质的不纯物质时,需将不纯物质的质量换算成纯净物的质量,才能代入化学方程式按质量比进行计算。常用的计算公式如下:
①不纯物质的化学方程式的计算(杂质不参加反应)
a.纯净物的质量=混合物的质量×纯度
考点1 化学方程式的书写
例1.(2023·湖南邵阳·统考中考真题)下列化学方程式书写正确的是( )
A.B.
C.D.
【答案】D
【解析】A.硫和氧气在点燃条件下生成二氧化硫,化学方程式为:,选项中化学方程式由于反应物中有气体,生成气体不用标气体符号,故选项书写错误,不符合题意;B.高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,化学方程式为:,选项中化学方程式没有配平,故选项书写错误,不符合题意;C.氧化铁与一氧化碳在高温条件下反应,生成铁和二氧化碳,化学方程式为:,选项中化学方程式没有反应条件,生成物化学式书写错误,故选项书写错误,不符合题意;D.氢氧化钙与二氧化碳反应,生成碳酸钙沉淀和水,化学方程式为:,故选项中化学方程式书写正确,符合题意;故选D。
考点2 根据化学方程式的简单计算
例2.(2023·湖南永州·统考中考真题)某化学兴趣小组通过实验测定石灰石中的含量(假定石灰石中只含有以及不与稀盐酸反应的杂质)。将50g石灰石加入到过量的稀盐酸中,产生的气体通入到足量的NaOH溶液中,测量NaOH溶液增加的质量变化如下图。
请回答下列问题:
(1)从上图中可以看出,50g石灰石与过量稀盐酸完全反应后生成气体的质量为______g(假定全部被NaOH溶液吸收)。
(2)计算石灰石中的质量分数(写出详细的计算过程)。
(3)有同学认为反应的时间,请分析,该结论______(填“正确”或“不正确”)。
【答案】(1)17.6;(2)80%;(3)不正确
【解析】(1)从图中可看出,氢氧化钠溶液增加的质量为17.6g,即为生成的二氧化碳的质量;
(2)解:设石灰石中CaCO3的质量分数为x
x=80%
答:石灰石中CaCO3的质量分数为80%;
(3)碳酸钙和盐酸的反应速率受盐酸浓度的影响,随着反应的进行,盐酸的浓度减少,则反应速率减慢,所以t2>2t1,结论不正确。
1.(2023·天津·统考中考真题)在反应中,下列有关说法正确的是( )
A.反应前后各元素的化合价均无变化
B.反应前后锌元素的质量没有发生改变
C.参加反应的碳与氧化锌的质量比为4:27
D.反应后固体质量减轻,不遵循质量守恒定律
【答案】B
【解析】A、反应前碳元素化合价为0,氧化锌中锌元素化合价为+2,反应后二氧化碳中碳元素化合价为+4,锌元素化合价为0,故A不符合题意;B、根据质量守恒定律知,化学反应前后锌元素的质量不变,故B符合题意;C、参加反应的碳与氧化锌的质量比为,故C不符合题意;D、由于生成二氧化碳气体,反应后固体质量减轻,仍遵循质量守恒定律,故D不符合题意。故选B。
2.(2022·山东临沂·统考中考真题)下列化学反应中,属于分解反应的是( )
A.B.
C.D.
【答案】B
【解析】A. 该反应的反应物有2种,不是分解反应。B. 该反应的反应物是1种,生成物是3种,符合“一变多”的特点,是分解反应。C. 该反应的反应物是2种,不是分解反应。D. 该反应的反应物是2种,不是分解反应。故选B。
3.(2023·江苏扬州·统考中考真题)Ca(OH)2与H2O2溶液反应可制备CaO2。反应过程包括:
步骤—:,其中O代表氧原子;
步骤二:主要发生,少量发生。
下列说法不正确的是( )
A.为增大反应混合物中Ca(OH)2的含量,应使用石灰乳而非石灰水
B.生成CaO2的总反应为
C.增加Ca(OH)2的用量,可以消耗更多O,减少O2的生成
D.制备时反应每生成72gCaO2,同时生成32gO2
【答案】D
【解析】A、氢氧化钙微溶于水,石灰乳中氢氧化钙的浓度远大于石灰水中氢氧化钙的浓度,所以为增大反应混合物中Ca(OH)2的含量,应使用石灰乳而非石灰水,选项正确;B、由题文可知,初始的反应物是氢氧化钙和过氧化氢,最终的生成物是过氧化钙和水,即生成CaO2的总反应为Ca(OH)2+H2O2=CaO2+2H2O,选项正确;C、由步骤二可知,增加Ca(OH)2的用量,可以消耗更多O,减少O2的生成,选项正确;D、由题文可知,反应中,少量发生O+O=O2↑,主要反应是Ca(OH)2+H2O2=CaO2+2H2O,制备时反应每生成72gCaO2,同时生成氧气的质量小于32g,选项错误,故选D。
4.(2022·黑龙江哈尔滨·统考中考真题)下列叙述和对应的化学方程式均正确的是( )
A.用木炭还原氧化铜C+2CuO2Cu+CO2↑
B.用天然气作燃料CH4+3O2=2CO2+H2O
C.氢氧化铝治疗胃酸过多H2SO4+AlOH=AlSO4+H2O
D.铁丝在空气中燃烧Fe+O2=Fe3O4
【答案】A
【解析】A、用木炭还原氧化铜,碳与氧化铜高温下反应生成二氧化碳和铜,该反应方程式为:,故A正确;B、用天然气作燃料,甲烷与氧气点燃生成二氧化碳和水,选项中缺少条件,配平错误,正确的反应方程式为:,故B错误;C、氢氧化铝治疗胃酸过多,胃酸的主要成分是盐酸,氢氧化铝与盐酸反应生成氯酸铝和水,该反应方程式为:,故C错误;D、铁丝在空气中不能燃烧,而铁在氧气中燃烧生成四氧化三铁,该反应方程式为:,故D错误;故选A。
5.(2022·四川攀枝花·统考中考真题)下图是一种获取清洁能源的化学反应微观示意图,下列说法不正确的是( )
A.从反应价值看:可以缓解温室效应
B.从物质分类看:该反应涉及2种氧化物
C.从微观构成看:4种物质均由分子构成
D.从表示方法看:该反应的化学方程式为2CO2+ 4H2O2CH4+ 3O2
【答案】D
【解析】A、反应为二氧化碳和水反应生成甲烷和氧气,从反应价值看:可以缓解温室效应,故A正确;B、反应物为二氧化碳和水,生成物为甲烷和氧气,氧化物是由两种元素组成,其中一种为氧元素的化合物,从物质分类看:该反应涉及2种氧化物,故B正确;C、反应物为二氧化碳和水,生成物为甲烷和氧气,从微观构成看:4种物质均由分子构成,故C正确;D、从表示方法看:该反应的化学方程式为,故D不正确。故选D。
6.(2022·四川攀枝花·统考中考真题)氢气吸入疗法是国家卫健委公布的新冠肺炎治疗手段之一。患者通过吸入氢气与氧气的体积比为2:1的混合气体来加助治疗肺部炎症,这种混合气体可以通过电解水(装置如图)得到。下列说法不正确的是( )
A.电解水的化学方程式为2H2O2H2↑+O2↑
B.可用带火星的木条检验b管产生的气体
C.a管与b管中产生的气体的质量比为2:1
D.使用氢气吸入疗法时,治疗区域内应严禁烟火
【答案】C
【解析】A、电解水时,水在通电的条件下反应生成氢气和氧气,反应的化学方程式为:2H2O2H2↑+O2↑,选项正确;B、连接电源正极的b管内生成的体积较小的气体是氧气,氧气具有助燃性,能够使带火星的木条复燃,所以可用带火星的木条检验b管产生的气体,选项正确;C、连接电源负极的a管内生成的气体是氢气,连接电源正极的b管中产生的气体是氢气,两种气体的体积比为2:1,选项错误;D、氢气具有可燃性,遇到明火能够与空气或氧气发生燃烧,甚至是爆炸,所以使用氢气吸入疗法时,治疗区域内应严禁烟火,选项正确;故选C。
7.(2022·江苏南通·统考中考真题)Na2S2O3溶液常用于测定I2的含量,反应原理为aNa2S2O3+bI2=cNaI+dNa2SxOy。向某I2溶液中滴加Na2S2O3溶液,反应过程中生成NaI的质量随所加溶液中Na2S2O3质量的变化如图所示。下列说法不正确的是( )
A.化学计量数a=c
B.Na2SxOy中x与y之比为2:3
C.0.316gNa2S2O3反应时,参与反应的I2的质量为0.254g
D.0.316gNa2S2O3反应时,生成Na2SxOy的质量为0.362g
【答案】D
【解析】依据质量守恒定律可知:化学反应前后原子个数不变,2a=c+2d,2a=xd,3a=yd,2b=c,a=2,b=1,c=2,d=1,x=4,y=6。A、化学计量数a=c,说法正确;B、Na2SxOy中x与y之比为2:3,说法正确;C、反应的化学方程式及其质量关系:
C、0.316gNa2S2O3反应时,参与反应的I2的质量为0.254g,说法正确;D、由C中数据可知,0.316gNa2S2O3反应时,生成Na2SxOy的质量为0.270g,说法错误;故选:D。
8.(2022·山东淄博·统考中考真题)如图是二氧化碳与碳在高温下反应的微观示意图,下列观点错误的是
A.从物质构成看:一氧化碳和二氧化碳都是由分子构成的
B.从定量角度看:参加反应的二氧化碳与生成的一氧化碳质量比为1:2
C.从反应实质看:化学反应的过程就是原子重新组合的过程
D.从表示方法看:该反应的化学方程式为CO2+C2CO
【答案】B
【解析】A、一氧化碳是由一氧化碳分子构成,二氧化碳是由二氧化碳分子构成,故A不符合题意;
B、由反应的微观示意图和化学方程式可知参加反应的二氧化碳与生成的一氧化碳的质量比为(1×44):(2×28) =11:14,故B符合题意;C、化学反应的实质是分子先分解成原子,原子重新排列组合,形成新的分子,故C不符合题意;D、根据反应的微观示意图可知,该反应的化学方程式为CO2+C2CO,故D不符合题意;故选B。
9.(2022·湖南湘西·统考中考真题)在反应2A+B2=2C中,21gA和足量B2在一定条件下充分反应生成33gC,已知B的相对原子质量为16,则A的相对分子质量是( )
A.26B.28
C.30D.32
【答案】B
【解析】根据质量守恒定律可知参与反应的B的质量=33g-21g=12g,设A的相对分子质量是x
x=28,故选B。
10.(2022·四川宜宾·统考中考真题)利用太阳能,以CO2为原料制取炭黑(C)的简易流程如图。下列说法错误的是( )
A.反应I为分解反应
B.生产过程中FeO可以循环利用
C.该方法有利于减少温室气体的排放
D.反应Ⅱ的化学方程式为:
【答案】D
【解析】A、由流程图可知,反应I是四氧化三铁在太阳能条件下分解生成FeO和氧气,该反应是由一种物质生成两种物质的反应,为分解反应,说法正确;B、由流程图可知,FeO既是反应I的生成物,又是反应Ⅱ的反应物,可以循环利用,说法正确;C、由流程图可知,该方法把CO2转化为炭黑(C),有利于减少温室气体的排放,说法正确;D、由流程图可知,反应Ⅱ是二氧化碳和氧化亚铁在450℃条件下反应生成四氧化三铁和碳,反应化学方程式为:,说法错误。故选:D。
11.(2022·山东东营·统考中考真题)已知过氧化钠(Na2O2)与水反应生成氢氧化钠和氧气。此反应涉及到的化学用语表示方法正确的是( )
A.两个氧分子:2O
B.Na2O2中氧的化合价
C.氢氧化钠由钠离子(Na1+)和氢氧根离子(OH1﹣)构成
D.此反应的化学方程式:2Na2O2+2H2O=4Na(OH)+O2
【答案】B
【解析】A、由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其分子符号前加上相应的数字,则两个氧分子可表示为:2O2;故A错误;B、由化合价的表示方法,在该元素符号的上方用正负号和数字表示,正负号在前,数字在后,根据化合物中正负化合价代数和为0的原则,过氧化钠中钠元素显示+1价,则氧元素为-1价,故可表示为:;故B正确;C、由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字,故氢氧化钠由钠离子(Na+)和氢氧根离子(OH﹣)构成,故C错误;D、氧化钠(Na2O2)与水反应生成氢氧化钠和氧气,该反应方程式为: