锌元素的化合价(锌元素化合价为正二价)
中考二轮复习真题自练自测
专题09 质量守恒定律(练习版+ 解析版)
1.【湖南怀化市】化学反应前后一定发生变化的是
A.原子数目B.分子数目
C.物质种类D.反应前后物质的总质量
2.【湖南省邵阳市】某纯净物X在氧气中高温煅烧的化学方程式为:4X+11O2
2Fe2O3+8SO2,则X的化学式是
A.FeSB.FeSO4C.FeS2D.Fe2O3
3.【河南省】钠着火不能用二氧化碳灭火。钠在二氧化碳中燃烧生成炭黑和一种白色固体,它可能是
A.碳酸钠B.硫酸钠C.碳酸氢钠D.氢氧化钠
4.【安徽省】如图是一种处理汽车尾气的反应微观示意图,有关说法正确的是
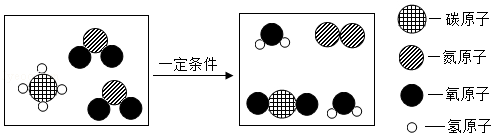
A.反应前后分子总数不变
B.反应前后原子种类发生变化
C.反应前后均为纯净物
D.该反应可以减少二氧化氮的排放
5.【辽宁省辽阳市】一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如下表所示。下列说法正确的是
物质
甲
乙
丙
丁
反应前质量/g
26
反应后质量/g
16
15
A.上表中X的值是0
B.该反应的基本反应类型是化合反应
C.乙一定是该反应的催化剂
D.丙和丁变化的质量比为14∶11
6.【云南省】在一定条件下,一密闭容器内发生某反应,测得反应前后各物质的质量如下表所示。下列说法不正确的是
物质
反应前的质量/g
40
16
15
反应后的质量/g
30
26
A.b可能是催化剂
B.X的值等于15
C.该反应是分解反应
D.参加反应的c与d的质量比为15∶13
7.【云南省昆明市】银器发暗是因为形成了黑色的Ag2S.欲使银器变亮,可先用洗衣粉洗去表面油污,再把它和铝片放入碳酸钠溶液中共煮,至银器恢复银白色时,取出银器,用水洗净即可。发生反应的化学方程式为:2A1+3Ag2S+6H2O6Ag+2Al(OH)3+3X↑,X的化学式是
A.H2SB.SO2C.SO3D.O2
8.【广西省梧州市】金属铝的冶炼要用到冰晶石,制备冰晶石的化学方程式为(冰晶石用A表示):12HF+3Na2CO3+2Al(OH)32A+3CO2+9H2O,则A的化学式为
A.NaAlF6B.Na2AlF4C.Na3AlF6D.Na3Al2F3
9.【江苏省扬州市】2KI+H2SO4+O3O2+M+K2SO4+H2O中M的化学式是
A.H2B.KOHC.HID.I2
10.【甘肃省天水市】把一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下。下列说法中正确的是
物质
反应前的质量(g)
6.4
3.2
4.0
2.8
反应后的质量(g)
5.2
7.2
2.8
A.x=2
B.d是催化剂,加快反应速率
C.c不是化合物
D.反应前后原子的数目不变
11.【云南省昆明市】在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少量,0表示物质质量不变),下列说法正确的是
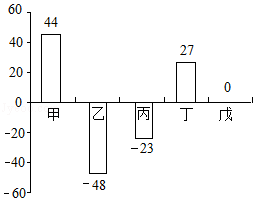
A.该反应一定属于置换反应
B.戊一定是该反应的催化剂
C.参加反应的乙、丙的质量比一定为48∶23
D.该反应中甲、丁的相对分子质量之比一定为44∶27
12.【湖北省宜昌市】硅是重要的半导体材料。X+H23HCl+Si(高纯)是工业制硅流程中的一个化学反应方程式,则X为
A.SiClB.SiCl3C.SiHCl3D.SiH2Cl3
13.【广西省梧州市】一定条件下,在密闭容器内发生了某反应,测得反应前后各物质的质量如下:
物质
反应前的质量/g
10
15
20
反应后的质量/g
10
下列说法错误的是
A.d可能是该反应的催化剂
B.c的质量范围一定是:0≤x≤30
C.参加反应的a与b的质量之比一定为2∶1
D.若16≤y≤36,则该反应一定是化合反应
14.【四川省广安市】在明代宋应星所著的《天工开物》中,有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团。”(注:炉甘石的主要成分是碳酸锌。)火法炼锌主要发生的化学反应是2C+ZnCO3
Zn+3X↑,下列说法不正确的是
A.X的化学式是CO
B.反应前后固体的质量不变
C.ZnCO3中碳元素的化合价为+4
D.该反应有元素的化合价发生改变
15.【广东省广州市】超氧化钾(KO2)常备于急救器和消防队员背包中,能迅速与水反应放出氧气:2KO2+2H2O2KOH+X+O2↑,关于此反应的说法不正确的是
A.X的化学式为H2O2
B.反应前后元素种类发生变化
C.反应前后氧元素化合价发生变化
D.反应前后物质状态发生变化
16.【四川省巴中市】自来水厂有一种新型的消毒剂ClO2,其工业生产原理是:2NaClO3+4X2ClO2↑+Cl2↑+2NaCl+2H2O,则X的化学式为________________。
17.【浙江省温州市】一些心脏病患者安装心脏起搏器,以在心跳骤停时刺激心脏,恢复心跳。一种用于心脏起搏器的锂电池,工作时发生的反应为4Li+2SOCl24LiCl+X+SO2↑。则X的化学式为________________。
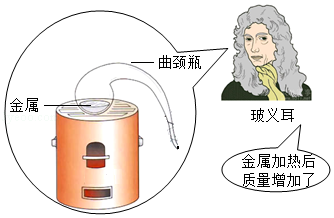
18.【浙江省绍兴市】材料一:1673年,玻义耳曾经做过一个实验:在密闭的曲颈瓶中加热金属时,得到了金属灰,冷却后打开容器,称量金属灰的质量,发现与原来金属相比质量增加了。
材料二:1703年,施塔尔提出“燃素学说”,其主要观点有:①燃素是组成物体的一种成分,一般条件下被禁锢在可燃物中;②燃素在可燃物燃烧时会分离出来,且燃素可穿透一切物质。
材料三:1756年,罗蒙诺索夫重做了玻义耳的实验。他将金属铅装入容器后密封、称量。然后把容器放到大火上加热,银白色的金属变成了灰黄色,待容器冷却后再次称量,发现容器的总质量没有发生变化。罗蒙诺索夫对此的解释是:“容器里原来有一定量的空气,且容器中的空气质量减少多少,金属灰的质量就比金属增加多少,在化学变化中物质的质量是守恒的。”后来,拉瓦锡等科学家经过大量的定量实验,推翻了“燃素学说”,质量守恒定律得到公认。
(1)由“燃素学说”可知,物质燃烧后质量应该减少。请根据所学知识写出一个可以推翻“燃素学说”的事实:__________________________________。
(2)罗蒙诺索夫重做了玻义耳的实验是基于金属加热后,增加的质量并非来自燃素而是来自________________的假设。
(3)对比材料一和材料三,玻义耳错过了发现质量守恒定律的一个重要原因是__________________________________。
(4)质量守恒定律的发现过程,给我们的启示是________________。
A.分析问题应该全面、严谨
B.实验的成功与否,取决于药品的选择
C.定量方法是科学研究的重要方法
D.科学研究既要尊重事实,也要勇于创新
各地中考化学试题分专题汇编:专题09 质量守恒定律(解析版)
1.【湖南怀化市】化学反应前后一定发生变化的是
A.原子数目B.分子数目
C.物质种类D.反应前后物质的总质量
【答案】C
【解析】化学反应前后,反应前后总质量一定不变;化学变化的实质是分子分成原子,原子再重新组合成新的分子,则原子种类、数目一定不变,则元素种类也不变。分子数目可能增加也可能减少,也可能前后相等;元素的化合价可能发生改变,也可能不变。化学变化一定有新物质生成,化学反应前后一定发生变化的是物质种类。故选C。
2.【湖南省邵阳市】某纯净物X在氧气中高温煅烧的化学方程式为:4X+11O2
2Fe2O3+8SO2,则X的化学式是
A.FeSB.FeSO4C.FeS2D.Fe2O3
【答案】C
【解析】由质量守恒定律:反应前后,原子种类、数目均不变,则4X分子中含有4个铁原子和8个硫原子,则每个X分子由1个铁原子和2个硫原子构成,则物质X的化学式为FeS2。故选C。
3.【河南省】钠着火不能用二氧化碳灭火。钠在二氧化碳中燃烧生成炭黑和一种白色固体,它可能是
A.碳酸钠B.硫酸钠C.碳酸氢钠D.氢氧化钠
【答案】A
【解析】A、白色固体可能是碳酸钠,该选项说法正确;B、白色固体不可能是硫酸钠,这是因为反应物中不含有硫元素,该选项说法不正确;C、白色固体不可能是碳酸氢钠,这是因为反应物中不含有氢元素,该选项说法不正确;D、白色固体不可能是氢氧化钠,这是因为反应物中不含有氢元素,该选项说法不正确。故选A。
4.【安徽省】如图是一种处理汽车尾气的反应微观示意图,有关说法正确的是

A.反应前后分子总数不变
B.反应前后原子种类发生变化
C.反应前后均为纯净物
D.该反应可以减少二氧化氮的排放
【答案】D
【解析】由微观反应示意图可知,该化学反应的化学方程式为:CH4+2NO2CO2+2H2O+N2。A、由化学方程式可知,反应前后分子总数发生了改变,故错误;B、由微观反应示意图可知,化学反应前后原子的种类没有改变,故错误;C、反应前和反应后均由多种分子,所以均属于混合物,故错误;D、由化学反应原理可知,该反应可以减少二氧化氮的排放,故正确。故选D。
5.【辽宁省辽阳市】一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如下表所示。下列说法正确的是
物质
甲
乙
丙
丁
反应前质量/g
26
反应后质量/g
16
15
A.上表中X的值是0
B.该反应的基本反应类型是化合反应
C.乙一定是该反应的催化剂
D.丙和丁变化的质量比为14∶11
【答案】D
【解析】A、X=26+8+2+4﹣1﹣16﹣15=8,故A错误;B、甲物质减少25 g,丙物质增加14 g,丁物质增加11 g,所以该反应属于分解反应,故B错误;C、乙可能是该反应的催化剂,可能没有参与反应,故C错误;D、丙和丁变化的质量比为14 g∶11 g=14∶11,故D正确。故选D。
6.【云南省】在一定条件下,一密闭容器内发生某反应,测得反应前后各物质的质量如下表所示。下列说法不正确的是
物质
反应前的质量/g
40
16
15
反应后的质量/g
30
26
A.b可能是催化剂
B.X的值等于15
C.该反应是分解反应
D.参加反应的c与d的质量比为15∶13
【答案】D
【解析】A、b反应前后质量不变,可能是催化剂,该选项说法正确;B、X=40+5+16+15﹣5﹣30﹣26=15,该选项说法正确;C、反应后a质量减小,是反应物,cd质量增大,是生成物,该反应是分解反应,该选项说法正确;D、参加反应的c与d的质量比为:(30﹣16)∶(26﹣15)=14∶11,该选项说法不正确。故选D。
7.【云南省昆明市】银器发暗是因为形成了黑色的Ag2S.欲使银器变亮,可先用洗衣粉洗去表面油污,再把它和铝片放入碳酸钠溶液中共煮,至银器恢复银白色时,取出银器,用水洗净即可。发生反应的化学方程式为:2A1+3Ag2S+6H2O6Ag+2Al(OH)3+3X↑,X的化学式是
A.H2SB.SO2C.SO3D.O2
【答案】A
【解析】由2A1+3Ag2S+6H2O6Ag+2Al(OH)3+3X↑可知,反应前后铝原子都是2个,银原子都是6个,反应前硫原子是3个,反应后应该是3个,包含在3X中,反应前氢原子是12个,反应后应该是12个,其中6个包含在3X中,反应前后氧原子都是6个,因此X化学式是H2S。故选A。
8.【广西省梧州市】金属铝的冶炼要用到冰晶石,制备冰晶石的化学方程式为(冰晶石用A表示):12HF+3Na2CO3+2Al(OH)32A+3CO2+9H2O,则A的化学式为
A.NaAlF6B.Na2AlF4C.Na3AlF6D.Na3Al2F3
【答案】C
【解析】由12HF+3Na2CO3+2Al(OH)32A+3CO2+9H2O可知,反应前后氢原子都是18个,反应前氟原子是12个,反应后应该是12个,包含在2A中,反应前钠原子是6个,反应后应该是6个,包含在2A中,反应前后碳原子都是3个,氧原子都是15个,反应前铝原子是2个,反应后应该是2个,包含在2A中,因此每个A分子中含有3个钠原子、1个铝原子和6个氟原子,A的化学式是Na3AlF6。故选C。
9.【江苏省扬州市】2KI+H2SO4+O3O2+M+K2SO4+H2O中M的化学式是
A.H2B.KOHC.HID.I2
【答案】D
【解析】由质量守恒定律:反应前后,原子种类、数目均不变,则每个M分子由2个碘原子构成,则物质M的化学式为I2。故选D。
10.【甘肃省天水市】把一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下。下列说法中正确的是
物质
反应前的质量(g)
6.4
3.2
4.0
2.8
反应后的质量(g)
5.2
7.2
2.8
A.x=2
B.d是催化剂,加快反应速率
C.c不是化合物
D.反应前后原子的数目不变
【答案】D
【解析】由表中数据分析可知,反应前后a的质量减少了6.4 g﹣5.2 g=1.2 g,故是反应物,参加反应的质量为1.2g;同理可以确定c是生成物,生成的质量为7.2 g﹣4.0 g=3.2 g;d的质量不变,可能作该反应的催化剂,也可能没有参加反应;由质量守恒定律,b应是反应物,且参加反应的b的质量为3.2 g﹣1.2 g=2 g,故x的数值为3.2 g﹣2 g=1.2 g。A、x=1.2,故选项说法错误;B、d的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法错误;C、该反应的反应物为a和b,生成物是c,符合“多变一”的形式,属于化合反应,C一定是化合物,故选项说法错误;D、反应前后原子的数目不变,故选项说法正确。故选D。
11.【云南省昆明市】在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少量,0表示物质质量不变),下列说法正确的是

A.该反应一定属于置换反应
B.戊一定是该反应的催化剂
C.参加反应的乙、丙的质量比一定为48∶23
D.该反应中甲、丁的相对分子质量之比一定为44∶27
【答案】C
【解析】A、反应后甲、丁质量增大,是生成物,乙、丙质量减小,是反应物,戊质量不变,可能是催化剂,也可能既不是催化剂也不是反应物和生成物,该反应不一定是置换反应,该选项说法不正确;B、戊不一定是该反应的催化剂,该选项说法不正确;C、参加反应的乙、丙的质量比一定为:48∶23,该选项说法正确;D、该反应中甲、丁的相对分子质量之比不一定为44∶27,即甲、丁化学计量数之比是1∶1时,甲、丁的相对分子质量之比为44∶27,甲、丁化学计量数之比不是1∶1时,甲、丁的相对分子质量之比不是44∶27,该选项说法不正确。故选C。
12.【湖北省宜昌市】硅是重要的半导体材料。X+H23HCl+Si(高纯)是工业制硅流程中的一个化学反应方程式,则X为
A.SiClB.SiCl3C.SiHCl3D.SiH2Cl3
【答案】C
【解析】由X+H23HCl+Si可知,反应后氢原子是3个,反应前应该是3个,其中1个包含在X中,反应后氯原子是3个,反应前应该是3个,包含在X中,反应后硅原子是1个,反应前应该是1个,包含在X中,因此X的化学式是SiHCl3。故选C。
13.【广西省梧州市】一定条件下,在密闭容器内发生了某反应,测得反应前后各物质的质量如下:
物质
反应前的质量/g
10
15
20
反应后的质量/g
10
下列说法错误的是
A.d可能是该反应的催化剂
B.c的质量范围一定是:0≤x≤30
C.参加反应的a与b的质量之比一定为2∶1
D.若16≤y≤36,则该反应一定是化合反应
【答案】B
【解析】A、如果y=1,则反应前后d质量不变,可能是催化剂,该选项说法正确;B、c的质量范围一定是:0≤x≤(10﹣0)+(15﹣10)+1+20=36,即1g完全反应生成c,该选项说法不正确;C、参加反应的a与b的质量之比一定为:(10﹣0):(15﹣10)=2:1,该选项说法正确;D、若16≤y≤36,则c质量不变,或减小直至减小到0,可能是反应物,也可能不是反应物、生成物,因此该反应一定是化合反应,该选项说法正确。故选B。
14.【四川省广安市】在明代宋应星所著的《天工开物》中,有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团。”(注:炉甘石的主要成分是碳酸锌。)火法炼锌主要发生的化学反应是2C+ZnCO3
Zn+3X↑,下列说法不正确的是
A.X的化学式是CO
B.反应前后固体的质量不变
C.ZnCO3中碳元素的化合价为+4
D.该反应有元素的化合价发生改变
【答案】B
【解析】A、由2C+ZnCO3
Zn+3X↑可知,反应前后锌原子都是1个,反应前碳原子、氧原子都是3个,反应后应该都是3个,包含在3X中,X的化学式是CO,该选项说法正确;B、反应生成一氧化碳气体,因此反应后固体的质量减小,该选项说法不正确;C、ZnCO3中锌元素化合价是+2,氧元素化合价是﹣2,根据化合物中元素化合价代数和为零可知,碳元素的化合价为+4,该选项说法正确;D、该反应有元素的化合价发生改变,例如锌元素化合价由0变成+2,碳元素由0变成+4,该选项说法正确。故选B。
15.【广东省广州市】超氧化钾(KO2)常备于急救器和消防队员背包中,能迅速与水反应放出氧气:2KO2+2H2O2KOH+X+O2↑,关于此反应的说法不正确的是
A.X的化学式为H2O2
B.反应前后元素种类发生变化
C.反应前后氧元素化合价发生变化
D.反应前后物质状态发生变化
【答案】B
【解析】A、由2KO2+2H2O2KOH+X+O2↑可知,反应前后钾原子都是2个,反应前氧原子是6个,反应后应该是6个,其中2个包含在X中,反应前氢原子是4个,反应后应该是4个,其中2个包含在X中,X的化学式是H2O2,该选项说法正确;B、反应前后元素种类不发生变化,该选项说法不正确;C、反应前后氧元素化合价发生变化,例如氧元素化合价发生了变化,该选项说法正确;D、反应前后物质状态发生变化,例如反应前没有气体,反应后生成气体,该选项说法正确。故选B。
16.【四川省巴中市】自来水厂有一种新型的消毒剂ClO2,其工业生产原理是:2NaClO3+4X2ClO2↑+Cl2↑+2NaCl+2H2O,则X的化学式为________________。
【答案】HCl
【解析】由质量守恒定律:反应前后,原子种类、数目均不变,则4X分子中含有4个氢原子和4个氯原子,则每个X分子由1个氢原子和1个氯原子构成,则物质X的化学式为HCl。
17.【浙江省温州市】一些心脏病患者安装心脏起搏器,以在心跳骤停时刺激心脏,恢复心跳。一种用于心脏起搏器的锂电池,工作时发生的反应为4Li+2SOCl24LiCl+X+SO2↑。则X的化学式为________________。
【答案】S
【解析】由4Li+2SOCl24LiCl+X+SO2↑可知,反应前后锂原子都是4个,氧原子都是2个,氯原子都是4个,反应前硫原子是2个,反应后应该是2个,其中1个S包含在X中,因此X的化学式是S。
18.【浙江省绍兴市】材料一:1673年,玻义耳曾经做过一个实验:在密闭的曲颈瓶中加热金属时,得到了金属灰,冷却后打开容器,称量金属灰的质量,发现与原来金属相比质量增加了。
材料二:1703年,施塔尔提出“燃素学说”,其主要观点有:①燃素是组成物体的一种成分,一般条件下被禁锢在可燃物中;②燃素在可燃物燃烧时会分离出来,且燃素可穿透一切物质。
材料三:1756年,罗蒙诺索夫重做了玻义耳的实验。他将金属铅装入容器后密封、称量。然后把容器放到大火上加热,银白色的金属变成了灰黄色,待容器冷却后再次称量,发现容器的总质量没有发生变化。罗蒙诺索夫对此的解释是:“容器里原来有一定量的空气,且容器中的空气质量减少多少,金属灰的质量就比金属增加多少,在化学变化中物质的质量是守恒的。”后来,拉瓦锡等科学家经过大量的定量实验,推翻了“燃素学说”,质量守恒定律得到公认。
(1)由“燃素学说”可知,物质燃烧后质量应该减少。请根据所学知识写出一个可以推翻“燃素学说”的事实:__________________________________。
(2)罗蒙诺索夫重做了玻义耳的实验是基于金属加热后,增加的质量并非来自燃素而是来自________________的假设。
(3)对比材料一和材料三,玻义耳错过了发现质量守恒定律的一个重要原因是__________________________________。
(4)质量守恒定律的发现过程,给我们的启示是________________。
A.分析问题应该全面、严谨
B.实验的成功与否,取决于药品的选择
C.定量方法是科学研究的重要方法
D.科学研究既要尊重事实,也要勇于创新

【答案】(1)铁丝燃烧后固体质量增大
(2)空气
(3)打开容器前没有称量容器的总质量
(4)ACD
【解析】(1)可以推翻“燃素学说”的事实:铁丝燃烧后固体质量增大等。
(2)罗蒙诺索夫重做了玻义耳的实验是基于金属加热后,增加的质量并非来自燃素而是来自空气的假设。
(3)对比材料一和材料三,玻义耳错过了发现质量守恒定律的一个重要原因是打开容器前没有称量容器的总质量。
(4)质量守恒定律的发现过程,给我们的启示是:分析问题应该全面、严谨,定量方法是科学研究的重要方法,科学研究既要尊重事实,也要勇于创新。故选ACD。

