碘元素的化合价(碘元素化合价是多少)
本文主要内容:高考范围内的化合价、氧化数相关讨论以及疯狂暗示入化竞。
提示:第一条分割线前的内容比较废话,可以直接往下拉到正文。
在初中阶段,大家肯定都学习过化合价的相关概念。
在人教版课本中给出的概念为:
化学上用化合价来表示原子之间相互化合的数目。
如果你问老师:所以这元素的化合价为啥是这个?
老师可能会说,一个元素的常见化合价和最外层电子数密切相关。在化学反应中得到几个电子,就显负几价;失去几个电子,就显正几价。
比如,O的最外层电子有6个,还差2个就满书上所说的最外层8个电子稳定了,因为得到了两个电子,所以显-2价。
这当然是一个在初中范围内比较通用的说法。想想是不是这个道理? mathrm {Na^+} 带着一个正电荷,显+1价; mathrm {Cl^-} 带着一个单位的负电荷,显-1价。两者按1:1的比例结合,电荷的代数和为0,物质显中性;也恰好契合了中性化合物中化合价之和为0的原则。
但是这个解释显然也有其局限性之处。
比如,从之后的学习中我们可以知道,铁的常见价态有+2价和+3价。考察它的结构,第四层有2个电子,第三层有14个电子;失去了最外层的2个电子,最外层还剩14个电子;即使是三价铁离子最外层也是13个电子,完全和我们所熟知的8电子规则不合。
再比如,bug般存在的过氧根。如果你问老师,为什么氧还有-1价这种操作?最外层七个电子不是完全不稳定的吗?
老师可能会说,所以它不稳定啊。
也有的老师会说,想那么多干嘛,背下来就是了呗。
于是,带着这样的疑惑,我们进入了高中阶段的学习。
在必修一刚开始学新课后不久,我们就可以在书中发现这么一句话。
氧化还原反应的实质是电子的得失或共用电子对的偏移。氧化还原反应往往伴随着化合价的升降。
8电子的小规律终于昭然若揭了——化合价和得失电子有密切联系实锤。
但是,得失电子好理解,为啥还有电子对的偏移?难道有玄机?
然后我就在一大堆关于氧化还原的题目的训练中迷失了自我,忘记了这个问题。这实在是太真实了……
但是,我也遇到了很多前所未有的怀疑人生的挑战。比如,为啥硫还有+2价( mathrm {S_2O_3^{2-}} )?为啥硫酸根还能“二聚”( mathrm {S_2O_8^{2-}} )?为啥硫和氧一样会有-1价神一般的存在 (mathrm {FeS_2} )?硫可真是一个磨人的小妖精啊。
于是,我得到的解释是:为了计算得失电子方便可以这么认为其化合价。具体的内容的话……你来上化竞啊嘻嘻嘻!
呵,男人。
虽然这不是我读化竞的原因,但是在学习了这块知识后,还是发现了化学,真是该死的有趣。
好了,废话这么多,终于进入正文了。
首先我们得明确,中学化学中的化合价,即为下文中的氧化数。
无机化学中关于氧化数的定义:
氧化数是反应化学反应中的电子迁移数或共价化合物中原子之间共用电子对的偏移数。
这就很有意思了。也就是说,在共价化合物中,如果一个原子吸引电子的能力比较强,把共用电子对拉去了,也就是使一个电子对偏向了自己,那么它就获得了一个负的化合价;相反,另一个被拉走共用电子对的倒霉蛋就获得了一个正的化合价。
这就解释了共价化合物中的凭什么你是正价我是负价的事实。
这么说很难直观反映事实,不妨看一些例子。
考察过氧化氢的结构式:
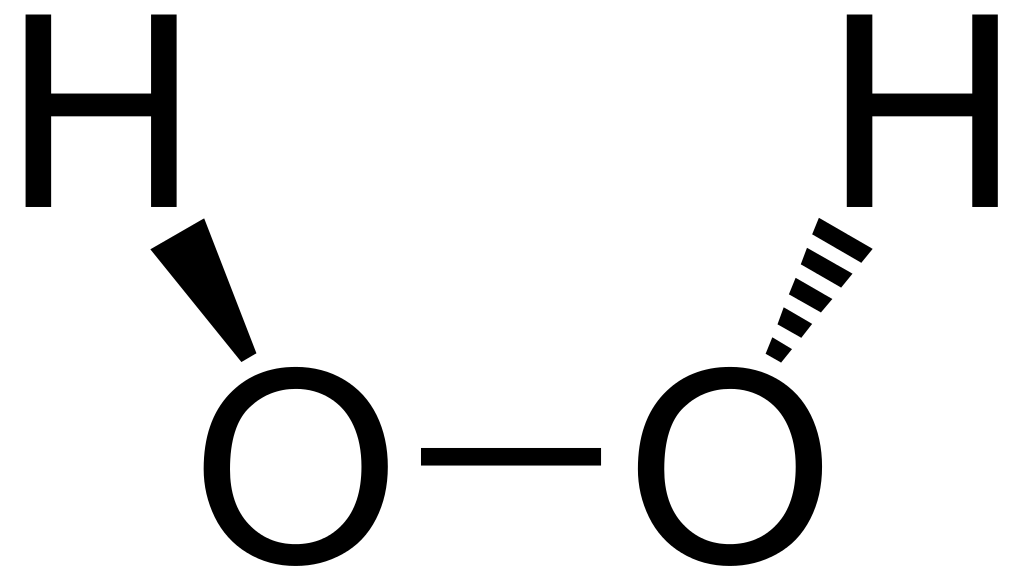
显然,两个氧势均力敌,根本没有办法把中间的这个电子对(即这根线)拉到自己的一边去。于是这对电子对在氧化数中并不起到任何作用。
然而,氢就比较可怜了——它孤家寡人和唯一相依为命的电子不仅要和氧共享,还要被氧强行拉到自己的一边去。谁叫自己弱小可怜又无助呢……
这个奇怪的东西是楔形式,表示其立体结构,不详细展开。可以理解为一根共价键,即一对共用电子对。不管是高考还是竞赛都会碰到。
于是,氧就获得了一个负的化合价,氢就获得了一个正的化合价。
这不仅解释了为啥过氧化氢中的氧是负价,还解释了它为什么是-1价。
同理,过硫根( mathrm{S_2^{2-}} )甚至多硫根( mathrm {S}_x^{2-} ),以及 mathrm {I_3^-} (KI溶液可以溶解更多碘的原理)存在的合法性也就得到了证明。
同时,我们只要稍加推理就可以发现,过二硫酸根,即上文提到的 mathrm {S_2O_8^{2-}} 中其实是有过氧键的存在的。完美解决了为啥硫会有+7价这种每个化学老师都遇到过的问题。所以,严格上来说,其氧化性来自于过氧根而不是硫,在被还原成硫酸根的时候S的价态实际上丝毫没有变动。具体结构读者可以尝试自行画出。
所以说,一个元素要是有分数价态,又有什么好笑的呢?
在做题目的时候,我们可以大胆地认为S的化合价为+2价,可以简化很多很多复杂的步骤。
但是,实际上呢?
其实聪明的小朋友已经发现了,从名字上看,硫代硫酸根,一个硫代了一个硫酸根中的氧,所以中心的S依然是+6价,簇拥着中心的S的3个O和一个S显-2价。
这么说不直观,来看图。
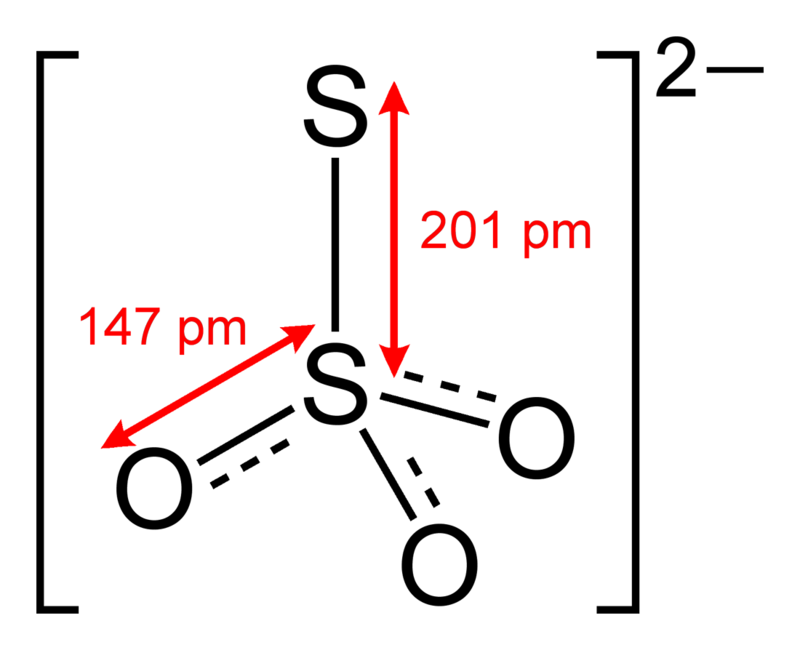
等等,你刚才不是说了,两个S势均力敌吗?边上的这个硫咋又有化合价了?
你当然可以理解为基团的两个负电荷是边上的S的,但是负电荷显然带在中心原子身上。
嘿嘿,想要解决这个问题,来学化竞啊!
Tips:雀占鸠巢的硫原子在此处配位。两个S并不等价。
但是,还不够给力啊,老师!(大雾)如何判断一个东西的电负性大小呢?
不好意思,说漏嘴了,如何判断一个电子对偏向谁呢?
如果我说,电子对偏向吸引电子能力强的原子,你又不高兴,那我怎么办?
很好办,引入大家大概都听说过的一个东西,叫电负性。
物质结构与性质一本选修中提到:
电负性用来衡量元素在化合物中吸引电子的能力。
下面是一张xld老师友情提供的表:
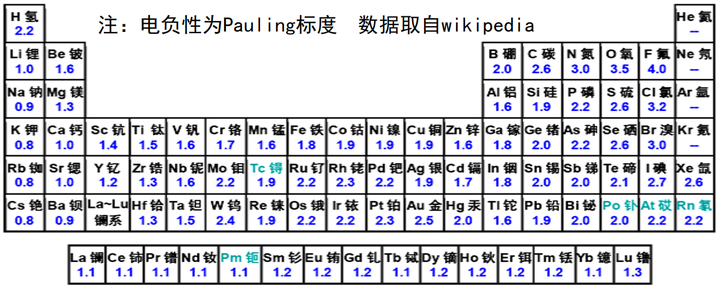
可以发现,一般来说,非金属电负性大于金属,非金属性越强电负性越大,氢的电负性大于大多数金属小于其他非金属。(至于为啥第六周期那么奇怪,可以搜索6s惰性电子对效应了解更多知识。想要系统学习,来!学!化!竞!)
电负性越大,电子越容易被吸过去,就越容易显负价。所以氨气中前面的N就是-3价,因为他无情地夺走了电子。至于为啥这么写,等我有空继续开坑呗。
至于为啥以F电负性为4.0作为标度,以及这是咋算出来的,啥是Pauling标度,想要知道的话,去学化竞啊!!!
这也可以解释很多事实。
很简单,它的电负性最大(非金属性最强),没有原子能夺走它的电子,也就是说没有东西能把它氧化。它就只能我 配 我 自 己或者拿着一对电子孤独终老了。
如果你做过卤素互化物的一些题目,你会发现,I永远正价,F永远负价,相互化合的话,永远是在周期表中靠上面的显负价,靠下面的显正价。
学了今天的知识以后,你,能解释了吗?
看着这个五氧化铬的Lewis结构示意图,思考Cr在 mathrm {CrO_5} 的氧化数。
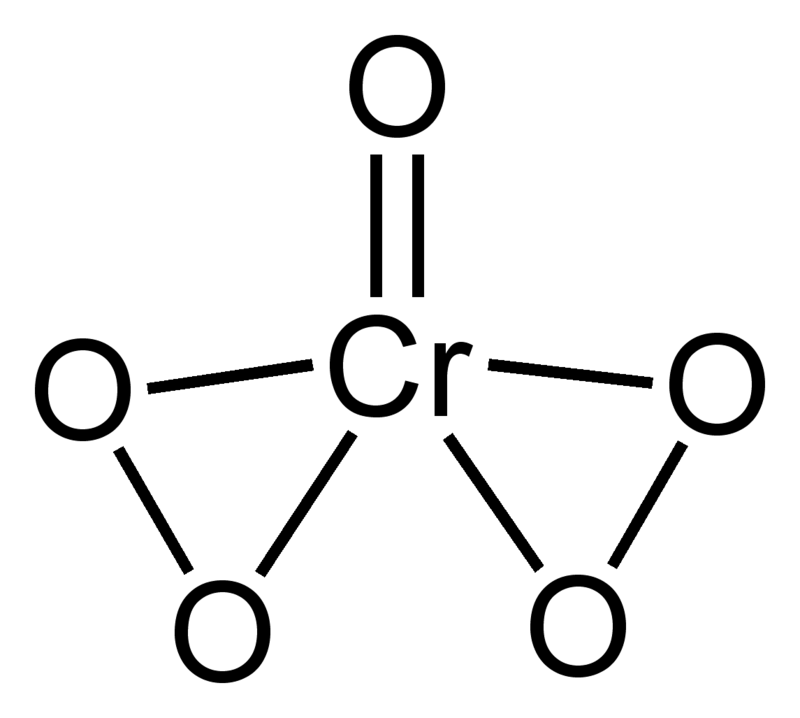
如果说+10价的话请允许我原地爆炸……
电负性当然还有很多应用,那又是一个天坑……
当然,这个理论依然是有缺陷的,等待更高级的方法来修正。
什么?你想知道是什么方法?来学化竞啊!!!(疯狂暗示)
不说了,要落泪了。化学真是迷人啊!
我拿已经不够的写作业的时间写的。码字不易,且读且珍惜。
本文结构式图源:Wikipedia和xld。

