hpv补硒怎么选择(补充硒元素对hpv有用吗)
不管高危和低危,感染HPV都有很大部分能够自我清除,所以如果检测到已感染了HPV,不要恐慌,但也不能轻视。
由Mahboobeh Safaeian等发布的Determinants of Incidence and Clearance of High-Risk Human Papillomavirus Infections in Rural Rakai, Uganda,研究了乌干达拉凯农村地区致癌性人乳头瘤病毒(HPV)感染的发生率和清除率。
在这项调查研究中,195名HPV女性贡献了389项观察结果(分析单位是特定类型的HPV感染),并进行了465人次的病毒清除率分析。随访期间清除了249例感染(53.55%)。
该研究数据表明,高危型HPV感染的3年自然清除率大约为50%,个别亚型自然清除率更低,如HPV31、HPV35、HPV16型的3年自然清除率分别只有16.7%、27.9%和38.3%。
下面是哥伦比亚的一项研究,Determinants of Clearance of Human Papillomavirus Infections in Colombian Women with Normal Cytology: A Population-based, 5-Year Follow-up Study
哥伦比亚国家癌症研究所的伦理委员会和国际癌症研究机构批准了研究方案。
以下是全文:
人们对影响人乳头瘤病毒 (HPV) 清除率的因素知之甚少,这是宫颈癌的主要原因。从 1,995 名哥伦比亚波哥大的 13-85 岁女性(平均随访时间为 5.3 年)组成的基于人群的队列中,共有 227 名女性细胞学正常且基线时 HPV 阳性。 HPV DNA 检测和病毒载量测定基于 GP5+/GP6+ 聚合酶链反应酶免疫分析。 HPV 清除率估计值是通过使用区间删失生存时间数据的方法计算的。分析基于 316 种特定类型的 HPV 感染。 HPV 16 的清除率明显低于低危型感染(比率比 (RR) = 0.47,95% 置信区间 (CI):0.32、0.72),与 HPV 16 相关的 HPV 类型(31、33、35 型) , 52, 58) 具有中等清除率 (RR = 0.62, 95% CI: 0.47, 0.94),与低风险类型相比,其他高风险类型未显示清除速度较慢的证据。单个和多个 HPV 类型的感染具有相似的清除率。没有证据表明清除率和病毒载量之间存在剂量反应关系。观察到经产妇女的清除速度较慢(RR = 0.64, 95% CI: 0.47, 0.89),而口服避孕药使用者的清除速度更快(RR = 1.38, 95% CI: 1.07, 1.77)。
流行病学和分子研究表明,人乳头瘤病毒 (HPV) 感染(主要是高危型)与宫颈癌之间存在因果关系。 然而,HPV 也是最常见的性传播媒介之一,并且已在 10-40% 没有细胞学异常的女性的宫颈上皮中检测到。 HPV 的流行与年龄有关,在年轻女性开始性活动后达到高峰。
HPV 感染大多是一种暂时现象,导致没有宫颈病变或导致通常自发消退的低度病变。 因此,HPV 的存在是宫颈瘤形成的必要但不充分的原因。 HPV 感染的持续存在似乎是发生宫颈上皮内瘤变 III 级 (CIN III) 和宫颈癌的先决条件。 病毒、宿主和环境因素可能会影响 HPV 感染的过程。
1993 年,哥伦比亚国家癌症研究所与国际癌症研究机构合作,开始了一项基于人群的队列研究,研究来自哥伦比亚波哥大的一组低收入妇女的 HPV 感染和宫颈瘤形成的自然史。该国是世界上宫颈癌发病率最高的国家之一(年龄标准化率为 34.4/100,000),本研究队列显示入组时 HPV 的患病率很高(细胞学正常的女性为 15%,26 20 岁以下女性的百分比)。
我们在此介绍对基线时宫颈细胞学检查正常的 HPV 阳性女性进行 5 年随访分析的结果。 分析侧重于HPV类型、病毒载量和各种女性特征对HPV感染清除率的可能作用。
材料和方法
患者和研究设计
1993 年 11 月至 1995 年 11 月,哥伦比亚国家癌症研究所在波哥大的四个卫生区进行了人口普查。 2000 名 18-85 岁的女性被随机确定并被邀请参加队列研究。此外,为了增加有关性活跃青少年的信息,还邀请了 200 名 13-17 岁的性活跃女性,她们自我转诊到青少年诊所进行避孕咨询。在招募时,这些女性回答了关于社会人口学特征、性行为、生育史、吸烟和饮食习惯的结构化问卷。面谈后,所有女性都被要求接受妇科检查,提供宫颈刮片(用于细胞学评估和 HPV DNA 检测),并提供 10 ml 血液。在被邀请参加研究的 2,200 名女性中,53 人拒绝参加,8 人被认为不符合条件(因精神疾病、子宫切除术或宫颈癌病史),29 人未提供细胞标本进行 HPV 检测,14 人未填写流行病学调查问卷。此外,由于 DNA 质量差(即未能扩增 β-珠蛋白基因),101 名女性的 HPV 检测不充分。
因此,共有 1,995 名 (91%) 具有有效问卷、有效 HPV 检测和适当宫颈细胞学检查的女性被纳入队列研究。 获得了所有研究参与者的知情同意。 哥伦比亚国家癌症研究所的伦理委员会和国际癌症研究机构批准了研究方案和从受试者获得知情同意的方式。
随访包括每 6 至 9 个月一次的访问。 每次就诊时,都会进行简短的随访问卷调查,并进行宫颈刮片以进行细胞学评估和 HPV 检测。 随访于 2000 年 12 月或诊断为 CIN III 时结束,以先发生者为准。 诊断为 CIN III 的女性接受了确诊活检和治疗。 在随访期间不知道女性的 HPV 状态,并且不影响临床管理。
此处描述的分析是对研究队列的一个子集进行的。 我们选择了 330 名在基线时对一种或多种 HPV 类型呈阳性的女性。 然后,我们将分析限制在细胞学正常的女性中(即,我们排除了 3 名细胞学不充分的女性和 51 名细胞学异常的女性;大多数证据为低度病变)。 最后,我们排除了 49 名没有至少进行过一次随访的女性,因此总共有 227 名女性。 由于每位女性都可能感染一种或多种不同类型的 HPV,因此我们的分析基于特定类型的 HPV 感染,而不是个别女性。 特定 HPV 类型的清除定义为在登记时检测到的 HPV 类型消失。 在任何访问中,如果 HPV 检测不充分,清除状态被认为是未知的,并继续随访。
聚合酶链反应检测HPV
HPV 检测是通过使用标准的 GP5+/GP6+ 聚合酶链反应 (PCR) 酶免疫分析法 (EIA) 进行的。简而言之,通过使用鸡尾酒探针检测高危和低危 HPV,对 HPV 阳性样本进行 EIA-HPV 组特异性分析 (16)。高危 HPV 鸡尾酒探针由 HPV 16、18、31、33、35、39、45、51、52、56、58、59、66 和 68 的寡聚探针组成;低风险 HPV 探针由 HPV 6、11、26、34、40、42、43、44、53、54、55、57、61、70、71(CP8061)、72、73、81( CP8304)、82 (MM4)、83 (MM7)、84(MM8)、IS39 和 CP6108。此外,通过 GP5+/GP6+ PCR 产物与来自 HPV 6、11、16、18、31 和 33 的克隆 DNA 的特定 DNA 片段的通用探针的 Southern 印迹杂交来评估 HPV 阳性。Southern 印迹分析阳性和阴性的样品通过高风险/低风险 EIA 被认为是 HPV X 或未确定的类型,并被归类为低风险。低风险鸡尾酒探针包含一些具有未知致癌潜力的 HPV 类型,即 26、34、53、73 和 IS39。出于分析目的,这些类型被归类为“高风险”。
在随访期间,开发了一种新的 GP5+/GP6+ PCR 反向线印迹分析,用于对 EIA 检测到的 37 种不同的 HPV 类型进行分型。 将 GP5+/GP6+ PCR 反向线印迹分析的结果与 PCR-EIA 分析的结果进行比较,发现在 96% 的情况下一致(kappa = 0.77)。
病毒载量分析
PCR-EIA 可用作评估宫颈刮片中 HPV DNA 相对量的半定量方法,因为 DNA 量与 10-106 基因组当量范围内的光密度呈线性关系。 根据 Jacobs 等人描述的方法进行半定量、非竞争性 GP5+/GP6+ PCR-EIA。 (19). 以两种方式分析样品的病毒载量:1)使用低(光密度,
统计方法
HPV 感染的清除时间通过使用区间截尾生存时间数据的方法建模。 这样做是必要的,因为从来没有精确地观察过清关时间,而只知道发生在两次访问之间。 生存函数(描述 HPV 感染清除的概率随时间变化)是通过使用非参数最大似然估计量估计的,这是 Kaplan-Meier 估计量对区间删失数据的自然推广。 如 Pan 所述,通过将 Cox 回归应用于估算的清除时间,得出比率估计值。 这些分析是通过使用生存包在 R 语言中实现的。 编写了定制软件来计算生存函数并进行多重插补。
考虑了以下可能与 HPV 清除相关的因素: 使用基于系统发育组分类的 HPV 类型(低风险类型、HPV 16、与 HPV 16 相关的类型(31、33、35、52、58)、HPV 18 和与 HPV 18 相关的类型(18、39、45、59、68,其他高危类型)、感染多样性、病毒载量(五分位数组)、年龄(
作为宫颈病变治疗的结果,HPV 感染可能会清除。 因此,在任何活检或治疗之日以及在任何情况下,当观察到 CIN III 或更严重的细胞学诊断时,对随访时间进行截尾。 这一选择导致对五名女性的审查。 三人仅感染了 HPV 16; 两名发展为 CIN III(在入组后第 17 和 54 个月),一名发展为浸润性宫颈癌(在第 58 个月)。 另外两名女性分别感染了 HPV 52 和 HPV 58,并分别在入组后第 5 个月和第 10 个月出现了一种 CIN III 和一种 CIN III。
结果
队列特征
本文提供了 227 名 HPV 阳性、细胞学正常的女性的数据,这些女性在入组和随访期间共检测了 1,373 份宫颈标本。 这组女性的中位随访时间为 5.3 年,就诊间隔的中位时间为 7 个月,中位就诊次数为 6 次。 77% 的女性至少有过四次访问。
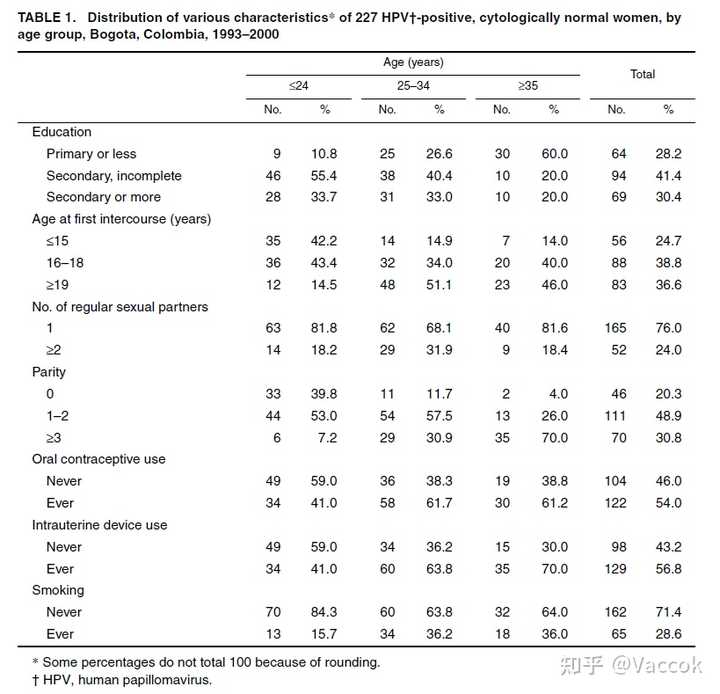
表 1 显示了细分为三个年龄组的研究人群的特征。 参与者的中位年龄为 29 岁。 28% 的女性报告仅受过小学教育,76% 有一个终身性伴侣,20% 没有生育过任何孩子。 54% 的女性曾使用过口服避孕药,57% 的女性曾使用过宫内节育器。 29% 的女性报告曾吸烟。
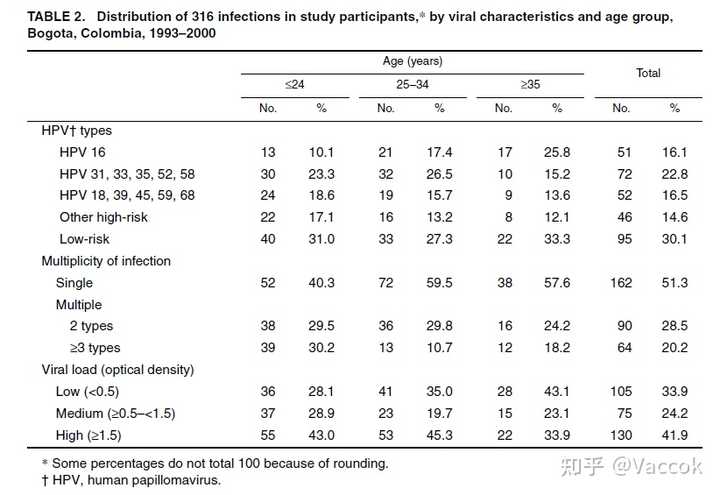
在研究开始时,总共在 227 名研究女性中检测到 316 例感染。 HPV 16 是最常检测到的 HPV 类型(占所有感染的 16%)(表 2)。在系统发育上与 HPV 16 相关的 HPV 类型占感染的 23%,与 HPV 18 相关的占 17%,其他高危 HPV 类型占 15%。在 HPV 16 之后,HPV 58(8%)、HPV 18(5%)和 HPV 45(5%)是最常见的高危类型。低风险类型占所有感染的 30%。在低风险 HPV 类型中,最常检测到的是 HPV 42(5%),其次是 HPV 81(CP8304)(4%)。与 35 岁或以上的女性相比,25 岁以下的女性感染 HPV 16 的比例较低,但其他高危 HPV 类型的感染更多,而低危 HPV 类型在所考虑的三个年龄组中的分布大致相等.检测到的 51% 的 HPV 感染是单一感染,而 20% 的感染与两种或更多其他 HPV 类型一起存在。与 25 岁或以上的女性相比,25 岁以下女性的多重感染更常见(表 2)。在 42% 的 HPV 感染中发现了高病毒载量,并且随着女性年龄的增长而略有下降(表 2)。
在单次感染中,52 例 (32%) 是低危型,73 例 (45%) 是 HPV 16 以外的高危型,37 例 (23%) 是 HPV 16。在多重感染中,14 例 (9%) ) 是 HPV 16,97 (63%) 是 HPV 16 以外的高危 HPV 类型感染,43 (28%) 是低危 HPV 类型感染。 在高危类型的存在与病毒载量之间发现了一些相关性。 在 55% 的 HPV 16 感染、46% 的 HPV 16 以外的高危型 HPV 感染和 27% 的低危 HPV 感染中检测到高病毒载量(数据未显示)。
HPV-DNA清除
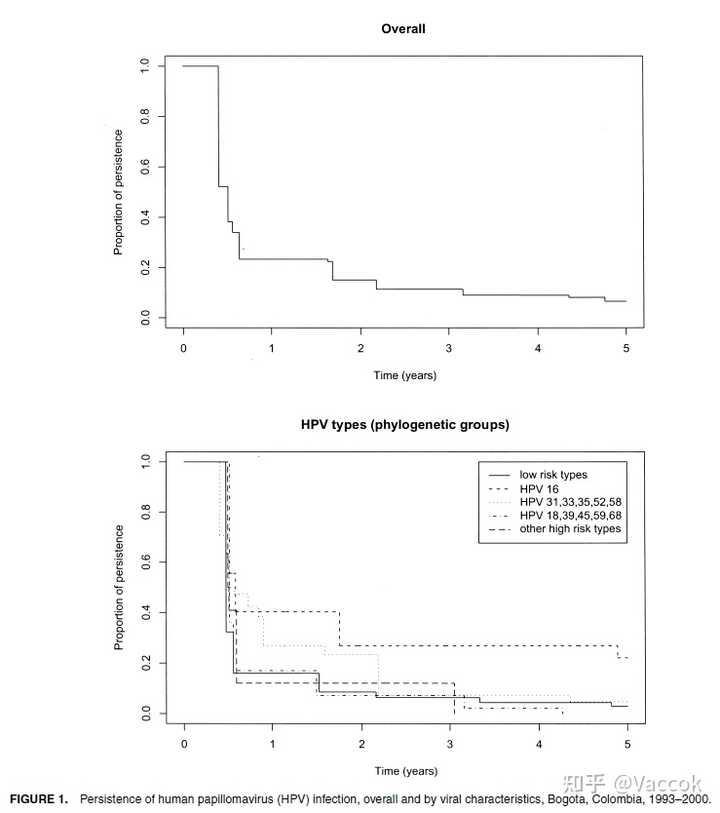
图 1 显示了持续性 HPV 感染的比例作为时间的函数,总体上和根据 HPV 系统发育组。 清除率不是恒定的,但在随访的前 6 个月最高。 在全球范围内,23% 的 HPV 感染在 1 年时仍然存在,7% 在 5 年时仍然存在。 HPV 16 的清除率低于低风险 HPV 类型。
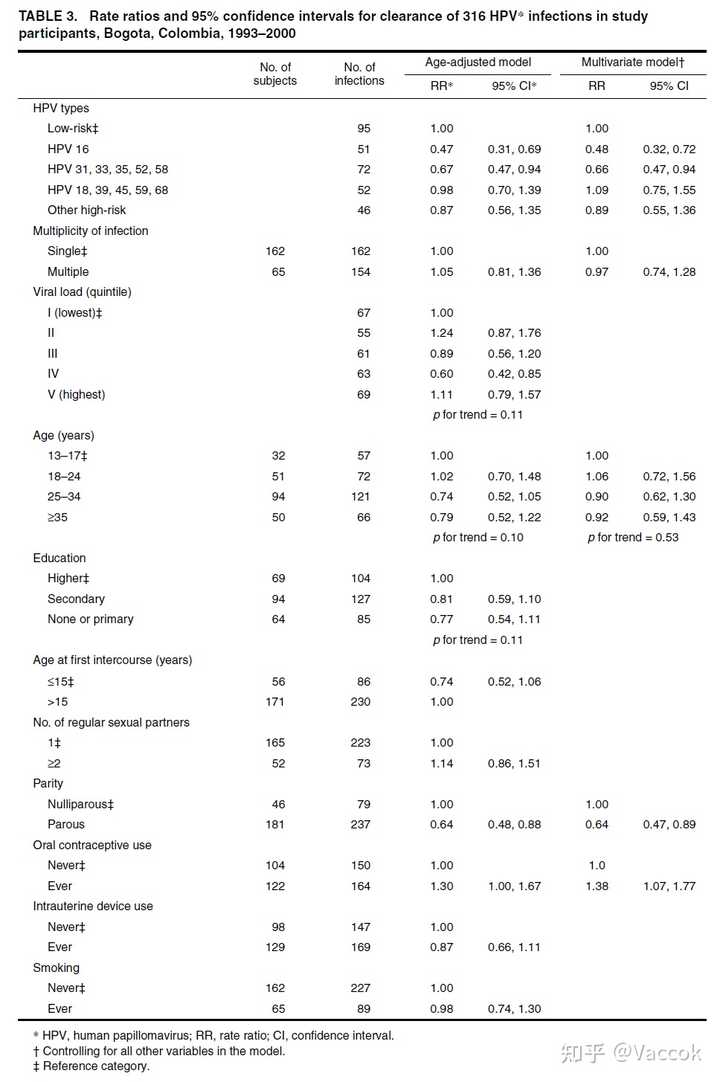
表 3 显示了多种病毒和宿主特征的 HPV 清除率的年龄调整和多变量比率。 关于病毒特征,发现不同 HPV 类型之间的清除率存在显着差异,但与感染多样性或病毒载量无关。 与低风险类型相比,HPV 16 及其相关类型(31、33、35、52、58)的清除率均降低。 相反,没有证据表明 HPV 18 连锁类型的清除率降低。 HPV 16 连锁型和 HPV 18 连锁型之间的清除率差异具有统计学意义(p = 0.001)。 在宿主特征方面,观察到经产妇女的清除率降低,而口服避孕药使用者的清除率增加。 教育和年龄的弱趋势很明显,但并不显着(表 3)。
然后将 HPV 类型、口服避孕药的使用和产次合并到一个多变量模型中。 年龄和感染多样性也被列为潜在的混杂因素。 多变量模型证实了 HPV 类型、口服避孕药的使用和产次的独立影响。
讨论
据我们所知,我们对 HPV 感染自然史的研究包括迄今为止报道的最长的随访。 它还表明,HPV 感染的清除主要发生在首次检测到 HPV 后的 2 年内,但之后很少发生。
在之前的一些研究中,在认为 HPV 感染被清除之前,需要进行两次或多次连续的 HPV 阴性检测。 我们认为在单次访问期间没有感染时感染已清除; 在我们的研究中,就诊之间的时间间隔相对较长(6-9 个月),因此可能足以清除感染。 事实上,在 223 例 HPV 感染中,只有 5 例已经清除并可以在随后的访问中重新评估,对于相同 HPV 类型的感染再次呈阳性。 因此,将 HPV 清除定义为两次连续的 HPV 阴性检测,而不是仅一次,因此不会对我们的结果产生重大影响。
在我们的分析中,HPV 16 的清除率低于低风险 HPV 类型的清除率。与 HPV 16 系统发育相关的高危 HPV 类型的清除率介于 HPV 16 和低危类型之间,而与 HPV 18 和其他高危类型相关的 HPV 类型的清除率与低危类型相似。 Franco 等人在巴西的一项后续研究(Ludwig-McGill 队列)中表明,低危型 HPV 类型的 12 个月清除率(12.2%,95% 置信区间:9.6、15.4)高于高危型风险 HPV 类型(9.5%,95% 置信区间:7.5、11.9),但 HPV 16 感染与 HPV 16 以外的高危类型感染之间没有发现明显差异(8.9%,95% 置信区间:5.8, 13.1)。在之前的后续研究中已经注意到 HPV 16 而不是 HPV 18 的持续时间比其他 HPV 类型更长的趋势,但这种现象的原因尚不清楚。到目前为止,HPV 16 是浸润性宫颈癌的主要类型,尽管怀疑 HPV 18 比 HPV 16 更快速地诱导向恶性肿瘤的转变。
使用 DNA 测序的研究表明,与其他高危类型相比,HPV 16 具有相当大的类型内多样性,这对于了解 HPV 16 逃避免疫监视的更大能力可能至关重要。 几项研究表明,HPV 16 的非欧洲变异可能与比欧洲变异更长的持续时间和更频繁地进展为临床相关的宫颈病变相关。 不幸的是,我们没有关于 HPV 16 变体的信息。
许多作者提出病毒载量与 HPV 感染的持续性之间存在关联。 我们使用半定量 PCR-EIA 方法来区分高病毒载量和低病毒载量感染,但没有发现持续性趋势或阈值效应的证据。 其他研究表明高病毒载量与持续的细胞学异常之间存在关联。 van Duin 等人观察到,细胞学正常的女性感染高病毒载量会增加发生 CIN 的风险,尤其是高级别 CIN。 相反,Lorincz 等人报告说,使用 Hybrid Capture 2 测试评估的 13 种高危型 HPV 的高病毒载量并不能预测 CIN III 的风险。
值得注意的是,以前的大多数研究仅关注 HPV 16 或测量总体病毒载量,而我们有关于 HPV 类型特异性病毒载量的信息。 不幸的是,目前尚不清楚高病毒载量是少数细胞具有大量病毒粒子的结果还是大量细胞具有少量病毒粒子的结果。
我们研究的另一个有趣发现是单个和多个 HPV 感染的清除率相似。 一些研究表明,持续性 HPV 感染与多种类型的存在之间存在关联。 这些研究被解释为好像具有多种类型的女性(例如,感染人类免疫缺陷病毒的女性)具有某些特征,例如对 HPV 的免疫反应不足,可能导致持续感染。 其他研究与我们的研究一样,表明清除特定类型的 HPV 感染似乎与是否存在与其他类型的合并感染无关,至少在免疫功能正常的女性中是这样。
几项横断面研究表明,女性的年龄是 HPV 流行的最强决定因素,通常在 25 岁以下的女性中观察到 HPV 感染的高峰。 一些研究表明,老年女性的 HPV 感染可能比年轻女性更持久。 这种差异的可能解释是选择持续感染、免疫反应降低、荷尔蒙变化以及老年妇女(或其性伴侣)的特定生活方式特征。 然而,我们没有证实年龄对清除率有任何不利影响,至少在细胞学涂片正常的女性中是这样。 在所考虑的三个年龄组中,我们确实发现 HPV 16 感染的比例稳步增加,但除 HPV 16 以外的高危类型的感染比例没有稳定增加。
与持续性和/或清除 HPV 感染相关的女性特征在所有研究中并不完全一致,并且并不总是与发现的增加宫颈癌风险的特征一致。例如,使用口服避孕药是 CIN III 和宫颈癌的危险因素。然而,在我们的研究中,与从未使用过口服避孕药的女性相比,曾经使用过口服避孕药的女性的 HPV 感染持续时间较短。在横断面研究和病例对照研究中,口服避孕药的使用与 HPV 感染的流行之间缺乏一致的关联。在前瞻性研究中,Moscicki 等人。发现口服避孕药的使用与 HPV 感染的清除之间没有关联,Castle 等人。发现 HPV 阳性女性使用口服避孕药与随后发生 CIN III 或宫颈癌之间没有关联。高胎次与 CIN III 和宫颈癌的风险增加有关。我们的研究结果表明,经产妇女的 HPV 感染可能比未产妇的持续时间更长。
我们的后续研究有几个优势,包括参与的女性人数众多,拒绝参与的比例低,以及存在关于广泛的病毒和生活方式因素的信息。 HPV 检测和分型是在中心实验室通过经过充分验证的敏感方法进行的。在我们对病毒载量的半定量评估中可能会出现一些错误分类,这会减弱病毒载量与 HPV 清除率之间的任何潜在剂量反应关系。在本研究中,后续访问的频率低于其他一些调查。尽管这种差异可能在一定程度上阻碍了我们捕捉 HPV 状态快速变化的能力,但它使我们能够减少由暂时性 HPV 感染的细胞学表现引起的不必要治疗的数量。最后,有关 HPV 状态的信息仅在本次随访结束时可用,排除了该知识对研究参与者临床管理的任何影响。
分析流行性而非偶发性 HPV 感染的决定既有优点也有缺点。一个优势是我们能够包括在研究开始前持续多年的感染,尤其是老年女性。一个缺点是我们没有所研究感染的完整自然史。因此,不应将图 1 中的清除率曲线解释为意外感染的清除率。请注意,随访的前 6 个月清除率很高,此后逐渐降低。这一发现可能被视为流行感染持续存在的可能性存在一些异质性的证据。我们对中位清除时间(6 个月)的估计低于先前报告的研究。这个估计正确地解释了清关时间的不确定性,这不是确切知道的,但已知只发生在两次访问之间。将清除日期与受试者 HPV 阴性的就诊时间等同的分析是不正确的,并导致对持久性的高估。在我们的研究中,这样的分析产生了 19.5 个月的中位清除时间的(错误)估计。
总之,我们发现不到一半的流行 HPV 感染会在 6 个月后持续存在,而在 5 年后只有 7%。 感染持续存在的最强风险因素是存在 HPV 16。
继续阅读
- 暂无推荐

