低钠血症补钠(低纳血症补钠公式)
李蔼文 | 广东省第二中医院检验科副主任技师
梁文坚 | 广东省第二中医院急诊科主任医师
前言
根据2014版欧洲低钠血症指南[1],以血清钠[2],严重者可引起低钠性脑病,早期表现为头痛、躁动、抽搐,继而表情淡漠、昏睡,甚至发生昏迷、呼吸停止和死亡[3]。和低钾血症比起来,临床讨论得不多,处理难度更大。如果简单粗暴地补充钠盐会导致错误的治疗甚至危及患者生命。
案例经过
患者,男,57岁,因“呕吐伴疲乏纳差6天”为主诉于2021年03月30日入院。入院症见:神疲乏力,恶心欲呕,纳差,间作呃逆,少许头晕,无头痛,无胸闷心慌,下腹按之不适,难以描述,但无腹胀。
查体:腹平软,未见腹壁静脉曲张,未见胃肠型及蠕动波,全腹无压痛及反跳痛,麦氏征阴性,墨菲氏征阴性,肝脾肋下未触及,四肢肌张力正常。入院前急诊查Na:98mmol/L,Cl:62.4mmol/L,K:2.99mmol/L。
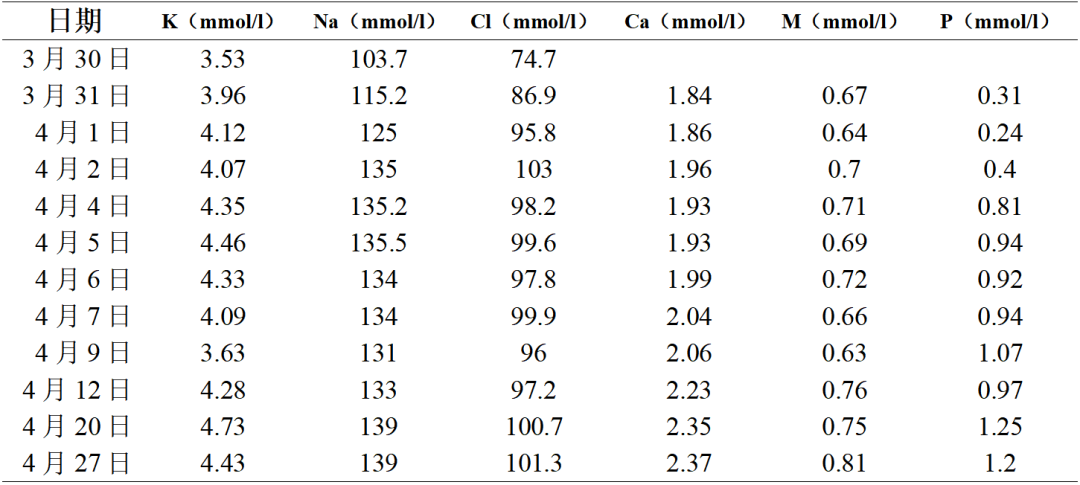
入院后予持续补充氯化钠(每天14~20g),但患者血清钠离子上升不明显,精神疲乏无改善。完善相关检查:血常规(除入院前注射1次升白针,入院时发热,白细胞升高外,其后复查均正常)、尿、肝、肾、蛋白、血脂、甲状腺功能检查基本正常,电解质和计算的血渗透压检查结果如下图1~3和表1:
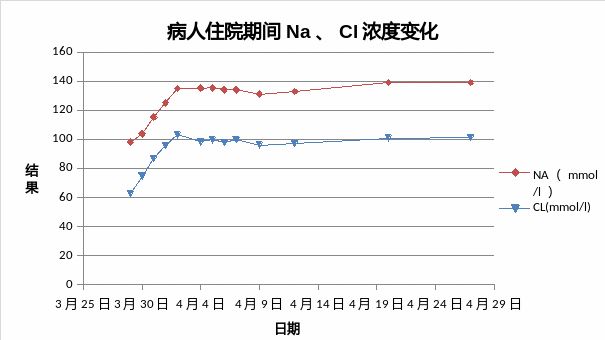
图1
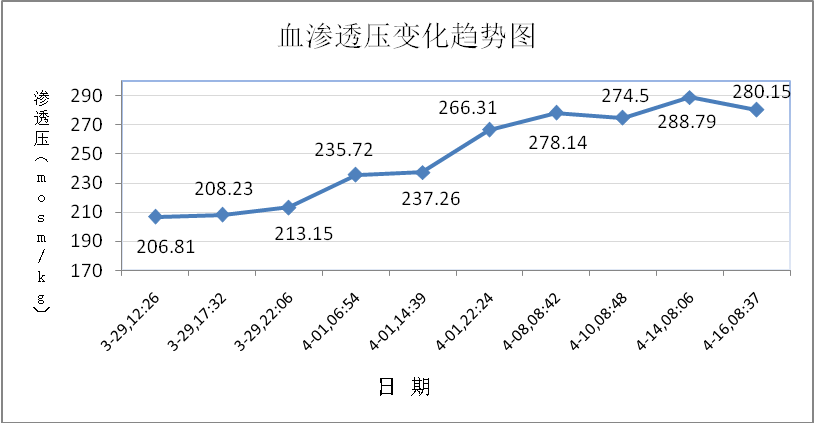
图2
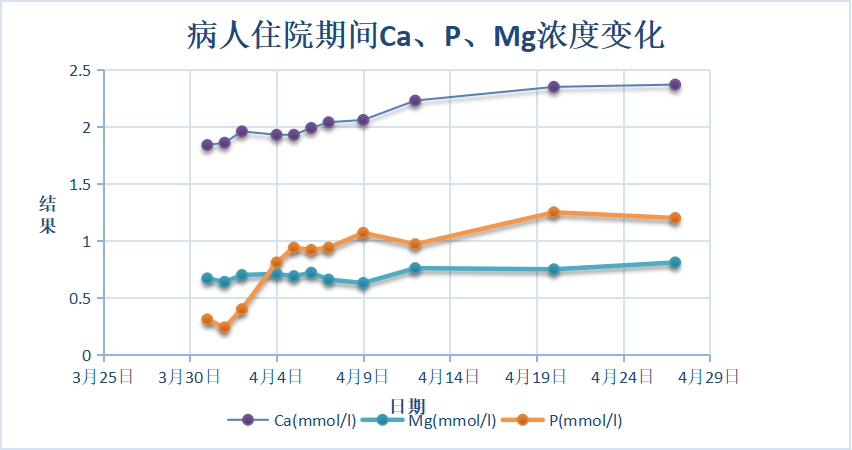
图3
表1 不同日期患者电解质变化
进一步完善其他检查提示:
1.入院时,血糖偏高9.81mmol/L,β-羟丁酸684.2μmol/L(参考范围:20-270μmol/L),糖化血红蛋白8.0%;
2.内分泌激素检查结果(化学发光法):8AM采血,结果见表2
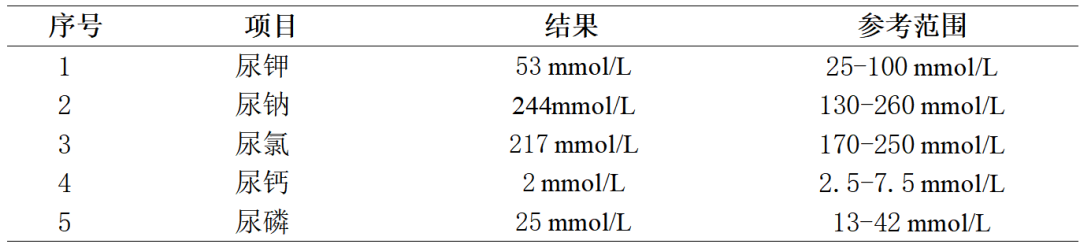
3.查患者24小时尿生化:24小时尿量为3300mL,结果见表3。
4.住院期间血压一直正常,BP110-130/70-80mmHg。
5.床旁超声筛查(心脏、腔静脉)未见血容量不足的声像。
表2 患者内分泌激素指标检查结果

表3 患者24小时尿生化结果(总尿量3300mL)
结合患者入院症状、体格检查、既往病史及相关检查结果,初步诊断为电解质代谢紊乱-重度低钠血症。正常情况下,补充14g钠盐,钠离子上升8mmol/L。但患者补充4g钠盐,钠离子上升不到1mmol/L。
经检查,患者肾上腺、皮质醇、甲状旁腺、甲状腺功能正常,无癫痫史,排除垂体功能减退或甲状旁腺功能异常、肾上腺皮质功能低下导致的低钠血症和电解质紊乱。
案例分析
临床案例分析
本案例中,患者是2型糖尿病患者,鼻咽癌复发药物化疗(PT方案:多西他赛+顺铂)+免疫治疗(PD1治疗:特瑞普利单抗)一程后,出现低钠血症,补钠效果不佳。
1.病史与检查分析:该患者合并糖尿病酮症、呕吐、鼻咽恶性肿瘤化疗史,经补充钠盐、纠正酮症治疗后,仍有低钠血症。低钠、有效血浆渗透压下降,24h尿钠正常高值,血容量正常(临床判断),明确低钠血症是细胞外液正常的低渗透性低钠血症,常见于抗利尿激素分泌不当综合征(SIADH)、肾上腺皮质功能减退及甲状腺功能减退、心肝肾功能衰竭。
该患者临床检验提示垂体功能、皮质醇、肝肾功能均正常,因此可排除后三者。而临床上导致发生抗利尿激素分泌不当综合征的病因中,以肿瘤多见。结合患者鼻咽恶性肿瘤化疗史,故考虑SIADH引起低渗透性低钠血症。
2.治疗:限水治疗是SIADH的主要治疗方法。通过严格限制水摄入,每日水摄入量在500-800mL即可以达到限水的作用。该患者通过严格限水、托伐普坦排水、静脉补钠(3-6g/L)等治疗后,血钠逐渐上升并稳定在正常水平,更进一步支持SIADH的诊断。
检验案例分析
本次案例中,按照低钠血症诊断流程(图4),应首先根据血渗透压>或<275mOsm/Kg区分低渗性或非低渗性(等渗或高渗)低钠血症。
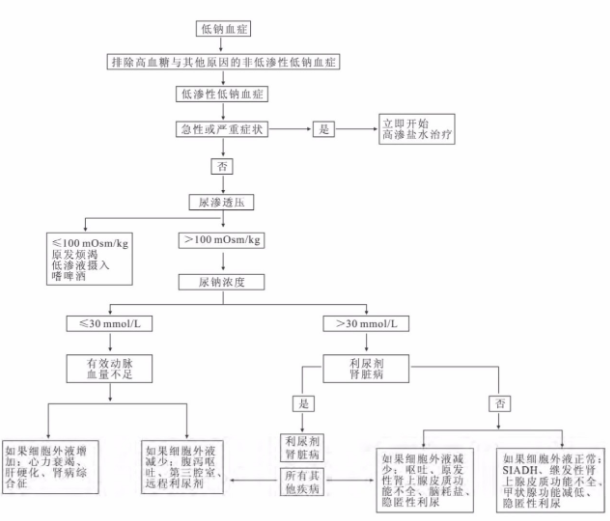
图4
常见高血糖引起的高渗性低钠血症通常是由于高血糖引起细胞外液渗透压增加,肾小球滤过率相应增加,导致渗透性利尿;同时可抑制肾小管重吸收钠,增加钠丢失而出现低钠血症[4]。
这种易位性低钠血症经常被认为是一种假性低钠血症[5]。因此,2014年欧洲低钠血症指南推荐在诊断及治疗低钠血症前应根据血糖计算出真正的血清钠浓度[1](矫正血钠公式如图5)。因此,当血糖在11~16mmol/L时,校正后的血钠浓度可能比检测高2~5mmol/L。该患者入院时血糖9.81mmol/L,校正后血钠浓度比检测高1-2mmol/L,仍然是重度低钠血症。
图5
但是,根据患者血渗透压
结合患者是鼻咽癌化疗药物完成后出现的疲乏、呕吐,24小时尿钠浓>30mmol/L,及24小时出入量等监测指标,排除原发或继发性肾上腺皮质功能低下引起的低渗性低钠血症,最常见的诱发因素是抗利尿激素分泌异常综合征。
而导致抗利尿激素分泌异常综合征的主要病因包括药物:如化疗药物、部分降脂药、吩噻嗪类药、抗抑郁药(三环类、选择性5-羟色胺再摄取抑制剂)、非甾体类抗炎药等可刺激ADH释放,从而引起SIADH[6]。因此,SIADH可能是患者诱发低钠血症的主要因素。
知识拓展
SIADH能继发于各种疾病,最常见的病因包括恶性肿瘤、中枢神经系统疾病、肺部疾病和药物。文献资料中由鼻咽癌引起的SIADH报告较少。
肿瘤患者常并发SIADH主要原因是肿瘤细胞异源性分泌ADH,而抗肿瘤药物使肿瘤细胞大量破坏释放ADH[7],导致不同程度的的低钠血症。化疗药物顺铂[8]可直接损伤肾小管上皮,影响重吸收,进而加重低钠血症。
研究表明[9],鳞状细胞肺癌患者中合并SIADH预后更差,是其独立的预后指标。同时低钠血症与患者的死亡率、发病率和住院时间有关[10]。
随着国内的癌症发病率逐年升高,检查技术和手段日趋成熟,恶性肿瘤并发SIADH的报道也越来越多,大部分患者都在确诊癌症后发现SIADH,但并非所有的SIADH均发生在恶性肿瘤确诊后。
故在医学工作中,针对顽固性低钠血症患者应注意其是否为SIADH,进而注意排查恶性肿瘤,做到早期诊断及治疗,降低病死率。在治疗SIADH过程中,要尽快纠正低钠血症,也要避免因血钠水平升高过快而引发的严重渗透性脱髓鞘综合征。由于SIADH的病情常随肿瘤的进展而加重,因此针对并发SIADH的癌症患者,肿瘤病因治疗及低钠血症对症治疗同等重要。
案例总结
低钠血症是临床常见的水盐失衡,其发生率占临床住院患者15%~30%,因其临床症状轻重不一,鉴别诊断复杂,可能延误治疗。文献提示110~125mmol/L时,患者症状明显且严重,病死率大大增加。因此,及时展开病因追踪分析,提出治疗建议,避免盲目补钠带来的脑损伤。
根据低钠血症的病理生理学机制,可将其分类:
(1)假性低钠血症:正常血浆含7%容积的固相物质(即含水量为93%)。在实际检验时,为了减少所需血标本量,通常在检测前对血清标本进行稀释。因稀释仅对溶液的液相部分而言,固相部分无法稀释,当血液中固相物质如脂肪和蛋白增加,所计算的离子水平将被低估。因患者血脂、蛋白正常暂排除。
(2)非低渗性低钠血症:血清含有其他渗透性物质使有效渗透压增加,吸引细胞内的水至细胞外液而导致细胞外液稀释所致低钠血症。因患者血糖偏高,校正后的血钠仍偏低。
(3)低渗性低钠血症:测得的血清渗透压<275mOsm/kg常提示为低渗性低钠血症,因为有效渗透压不会高于总的或测得的渗透压。根据患者的循环血量状况,结合血钠、渗透压、等重点监测指标与临床表现,患者最终被定性为急性危重性等容量性低渗性低钠血症。
等容量性低渗性低钠血症,最常见的诱发因素就是抗利尿激素分泌异常综合征(SIADH)。根据SIADH的诊断标准:有效血浆渗透压100mOsm/Kg,正常的盐和水摄入量下,尿钠浓度>30mmL/L,无肾上腺、甲状腺、垂体或肾功能不全,最近没有使用利尿剂。患者虽未完善尿渗透压检测,但结合尿比密正常及其他监测指标基本符合,SIADH可能是患者诱发低钠血症主要因素,并且化疗药物可能是患者导致SIADH的主要原因。
化疗相关性低钠血症还可能与以下因素有关:肾毒性化疗药物因大量水化造成非电解质液体输入过多,尿量减少;化疗直接损伤肾小管上皮细胞干扰钠的重吸收;化疗引起胃肠道反应导致钠摄入不足,丢失过多或非渗透性刺激抗利尿激素(ADH,antidiuretichormone)释放作用;应用利尿剂、脱水剂经肾丢失或者大量出汗经皮肤丢失等。
因此,当肿瘤患者化疗后出现乏力、头痛、嗜睡、尿量减少等症状警惕为低钠血症的早期症状,应密切观察患者意识和精神状态,及时检测血尿电解质浓度、血尿渗透压水平等,适时完善影像学检查。
专家点评
临床上低钠血症非常常见,但重视程度仍有欠缺。临床上可见假性低钠血症、高血糖及其他原因导致的非低渗性低钠血症,完善肝肾功能、血尿离子、血容量、甲状腺功能、肾上腺皮质功能、垂体功能等相关检查以协助病因诊断。其治疗原则是基于病情的全面评估,分清缓急;密切监测,权衡利弊,控制补钠速度。
本案例从持续补充氯化钠,但患者血清钠离子上升不明显,怀疑检验结果是否不准确开始,通过与检验科、内分泌科密切沟通,结合病史、检查结果,考虑低钠血症的诱发因素是由化疗药物引起的抗利尿激素分泌异常综合征。经规范限水、补钠、补钾、镁,同时胰岛素降糖治疗后,患者血钠上升并稳定至正常水平。
整个案例思路清晰、数据真实地分析了低钠血症的检查、排除、诊断分析思路,更好地展示了检验科在临床诊疗中发挥的重要作用,通过相互交流、相互沟通,共同提高临床诊疗水平。
点评专家:李典鸿,广东省第二中医院急诊科主任,主任中医师。
特别鸣谢:
莫伟,广东省第二中医院内分泌科主任,副主任中医师对本案例的分析支持
参考文献
[1] Van BW,Vanholder R. Clinical Practice Guidelines on diagnosis and treatmentof hyponatraemia: response to letter from Otsuka Ltd. EuropeanJournal of Endocrinology, 2014, 171(1):L5-L6.
[2] GOH KP.Management of hyponatremia[J].AmFain Physician,2004,69(10):2387-2394.
[3] BERARDIR,RINALDIS,CARAMANTIM,et al.Hyponatremia in cancer patients:timefor a newapproach[J].CritRev Oncol Hematol,2016,102:15-25.DOI:10.1016/j.critrevonc.2016.03.010
[4]李振华,殷晓明.老年患者低钠血症50例临床分析.安徽医药,2016,20(9):1707-1709.
[5] Hoorn EJ ,Carlotti APCP , Costa LAA , et al. Preventing a Drop in EffectivePlasmaOsmolality to Minimize the Likelihood of Cerebral Edema DuringTreatment of Children withDiabeticKetoacidosis. Journal ofPediatrics, 2007, 150(5):467-473.
[6] SUGIYAMAY,NAIKIT,KONDOM,et al.Syndrome of inappropriate secretion of antidiuretic hormone caused bycarboplatin after switching from cisplatin in a metastatic urethralcancer patient[J].UrolCase Rep,2017,12:17-19,DOI:10.1016/j.eucr.2017.02.001.
[7]覃晶,蔡菊芬,卢红阳.小细胞肺癌伴发抗利尿激素异常分综合征诊治研究进展[J].实用医学杂志,2014,30(3):289-491.
[8] Iyer AV,KRASNOW SH, Dufour DR, et al. Sodium-wastingnephropathy in patientswith small-cell lung cancer caused by cisplatin [J]. Clin LungCancer, 2003, 5(3): 187-189.
[9] Wang X, Liu M,Zhang L, et al. Syndrome antidiuretic hormone secretion: a prognosisfor small-cell lung cancer [J]. Arch Med Res, 2016, 47 (1): 19-24.
[10] Spasovski G,Vanolder R, Alio B, et al. Clinical practice guideline on diagnosis andtreatment of hyponatraemia [J]. Eur J, Endocrinol, 2014, 170(3):G1-G47.
END

