微量元素 铅(重庆铅元素动画)
1.引言
有机元素通常是指在有机化合物中分布较广和较为常见的元素,如碳(C)、氢(H)、氧(O)、氮(N)、硫(S)等元素,这些常见的有机元素组成了各种各样形形色色的有机物。有机物是生命产生的物质基础,所有的生命体都含有机化合物,如脂肪、氨基酸、蛋白质、糖、血红素、叶绿素、酶、激素等。生物体内的新陈代谢和生物的遗传现象,都涉及到有机化合物的转变。此外,许多与人类生活密切相关的物质,如石油、天然气、棉花、染料、化纤、塑料、有机玻璃、天然和合成药物等,均与有机化合物有着紧密的联系,因此,对有机元素(C、H、O、N、P、S等)的分析检测至关重要。
从广义上来说,有机元素定量分析是一种测定有机化合物组成元素含量的科学。通过测试有机化合物中各有机元素的含量,可确定化合物中各元素的组成比例进而得到该化合物的实验式。基于此,有机元素定量分析的目的有两个:
(1)确定有机化合物组成:常用于新和成的有机化合物或者是天然提取物的分析,是确定其结构的必须一环。
(2)确定有机组分含量:常见于无合适分析方法或分析方法繁琐的化合物含量的测定,此时可利用其所含有的某一特征元素,通过测定其含量而折换成该化合物的含量。
目前,元素的一般分析法有化学法、光谱法、能谱法等,其中化学法是最经典的分析方法。传统的化学元素分析方法,具有分析时间长、工作量大等不足。而其中,有机元素分析最早出现在19世纪30年代,李比希首先建立了燃烧方法测定样品中碳和氢两种元素的含量,他首先将样品充分燃烧,使碳和氢分别转化为二氧化碳和水蒸气,然后分别以氢氧化钾溶液和氧化钙吸收,根据各吸收管的重量变化分别计算出碳和氢的含量。
几十年来,有机元素定量分析对有机化学的发展作出了巨大的贡献,同时,有机化学的发展又推动着有机元素定量分析不断向前发展,纵观整个过程,有机元素定量分析的发展主要经历了以下三个阶段。
第一个阶段是1912年到1940年左右,属于经典方法阶段,即试样在缓慢的氧气和空气中进行燃烧分解,燃烧产物以称重方式进行定量,然而这种分析方法耗时较长。
第二个阶段是1940年到1960年左右,此时对碳、氢等元素的定量分析主要集中于提高氧化剂的效能、加快燃烧速度等方面的改进,如加快氧气流速、提高燃烧温度以缩短燃烧分解时间,如应用各种高效能的催化氧化剂以提高氧化性能和除去干扰元素等。该阶段还重点发展含硅、氟、磷、金属等元素的有机物的碳、氢元素分析和几种元素同时存在的分析法。
第三个阶段是从六十年代开始,碳、氢等微量元素定量分析由于成功的采用了多种新技术、新方法,如热导检出的气相色谱,示差吸收法以及各种电化学分析法等,使得几十年来主要凭借手工操作的落后面貌得以彻底的革新。
近年来,电子天平和电子计算机技术的引入,使全自动分析成为可能。因此,在飞速发展的过程中,对有机物中元素的测量范围也在逐渐扩大。目前,利用各种有机元素定量分析方法可以测量出的元素包括碳、氢、氧、磷、硫以及微量痕量金属等。
2.样品的制备与称量
有机微量分析和元素分析要求所测样品是不含吸附水分及溶剂的均匀固体微粒或液体,并且在称量过程中不应该有任何的污染或成分的改变(如易挥发组分的缺失)。
需要特别说明一点,对于氮元素含量的测定,仪器所测到的是总氮量,这意味着空气吸附会对最后结果带来或多或少的影响。对碳、氢和氧元素的污染会来自于接触称量器皿和环境的湿度,取样环境湿度较大或样品中潮气的存在均对测定结果有明显的影响。具体来讲,样品应该满足以下要求。
(1)样品必须提纯、干燥;
(2)固体、液体样品的熔程、沸程必须在允许范围内;
(3)固体样品应装在玻璃或塑料小瓶中,不能用软木塞或橡胶塞直接封口;
(4)样品应有足够的量,以满足方法和仪器的线性和灵敏度要求;
(5)感光样品应有避光的外包装;
(6)样品如需玻璃封管,则玻璃管应有一定厚度,以避免开管使玻璃屑散落。
同时,测试时样品的称量也至关重要。样品的最佳称样量取决于样品中被测元素的含量、样品的均一性和样品燃烧的难易程度。对于每一个被测元素,其绝对量必须在测量仪器所校正的工作范围内,也就是说,样品的称样量取决于被测元素的含量和仪器或方法的动态工作范围。如果样品是已知的,则称量范围可以通过以下方法估计,即先计算出能使每个元素达到各自的校正曲线最高和最低限所需的样品量,那么最低称样量就是达到校正曲线最低限所需的样品质量,最高称样量就是达到校正曲线最高限所需的样品质量。如果样品是未知的,则一般先称取2~10 mg的样品进行测试,根据结果来决定最佳称样量。
当然,具体情况具体分析,实际测试前,对不同的样品应选择不同的称样量和制样技术。
3.有机元素定量分析
虽然有机物的常见组成元素大同小异,然而,不同的有机物依然含有许多不同的微量元素。为了深入解析有机元素定量分析技术,笔者对有机物中常见的元素的定量分析进行了详细总结(图1)。
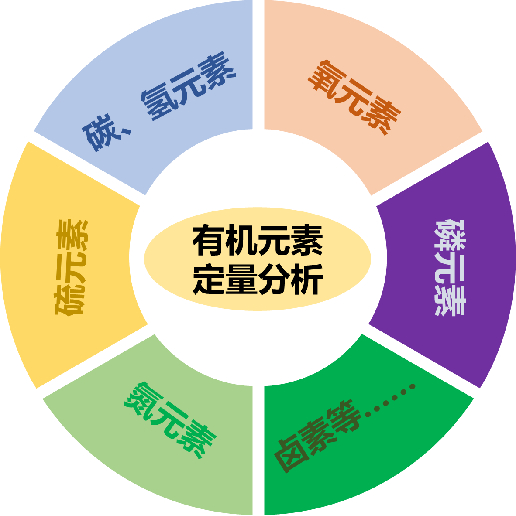
图1 常见定量分析的有机元素
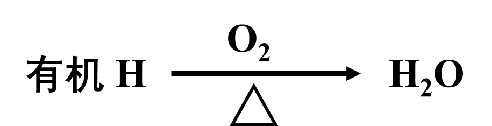
在进行分析测试前,通常用锡制容器(锡舟、锡筒)包裹的精确称量的标准物质或被测样品被元素分析仪的自动进样盘带入燃烧反应管中,由于遇氧和锡制容器的瞬间燃烧,样品的分解温度可以达到1800℃左右,在燃烧反应管中填装的催化氧化剂的作用下,被测样品中的碳、氢元素分别被转化为CO2和H2O,此混合气体以氦气作为载气,进入还原管与所填装的还原铜作用,除去过量的氧气。CO2和H2O被氦气从还原管中带出后分别被吸附在特制的吸附柱上。接着,CO2和H2O的吸附-解吸柱依次升温,使CO2和H2O解吸后依次进入热导池进行检测。最后,热导池中化学组分转化成的电信号由计算机进行数据处理。
分析过程中用到的氦气(作为吹扫气和载气)和氧气(作为助燃气体)在进入系统前必须经过纯化管得到纯化,主要是干燥和吸收挥发性的卤素和酸性气体,以达到微量化学分析的要求。整个自动分析过程,包括参数的设置等均由仪器所附软件来完成,加氧量根据样品的基质通过软件来调节。另外,在CO2-吸附解吸柱前后都装有干燥管以干燥被测的CO2。
以碳纤维、焦炭类样品为例,这类样品是一些含碳量非常高的有机或者无机的物质。分析此类化合物的关键在于确保样品的完全燃烧,防止其焦化。为此,可以减少称样量或在称量时在样品上覆盖少量的V2O5。V2O5能够分散样品颗粒,防止样品焦化,同时在有氧气的条件下循环式地释放出氧化性能强的原子氧,必要时还可以增大O2的量,以确保样品的完全燃烧。需要指出的是,纤维类样品的制样条件直接影响着样品的性质,如均匀性与易燃程度。制样条件包括样品的颗粒度、表面吸附性能、样品的干燥温度和时间、样品的冷却条件和时间等。
表1利用经典燃烧法列出了一些碳纤维、焦炭类样品的碳、氢元素质量分数的测定结果[1],可以看到,其实测值的误差均较小,证明了这种方法的可行性。
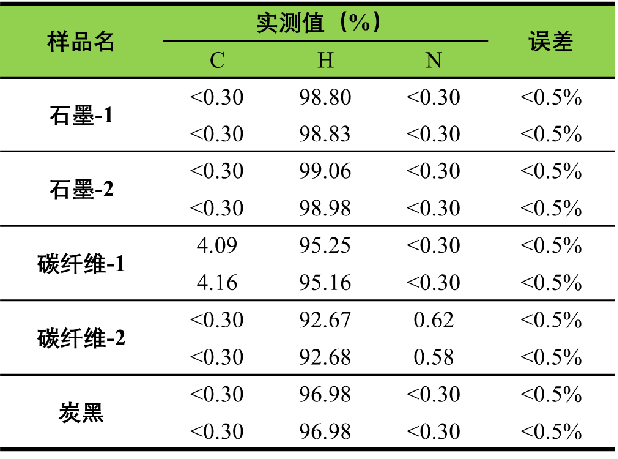
表1 对碳纤维、焦炭类样品中的碳、氢元素含量的测定
3.2 氧元素分析
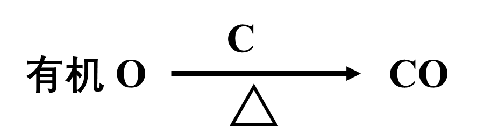
与有机物中碳、氢元素的微量定量分析相似,有机物中氧元素的分析也经历了经典法阶段、催化剂研制阶段和全自动分析阶段[2]。经典法采用碳化还原法,20世纪50年代奥依塔(I.J.Oita)等用铂-碳催化剂代替了碳,从而降低了含氧有机物的热分解温度,使经典法得到了广泛应用。碳化还原法的基本原理(见下化学方程式)是使含氧有机物在高温的惰性气流中进行分解,热分解产物在通过高温碳层(或铂-碳层)时含氧的成分全部定量转变为一氧化碳,在除去干扰产物后,用无水的碘酸(或氧化铜)将一氧化碳定量转化为二氧化碳,同时释放出碘单质。可以用重量法测定二氧化碳或碘单质的增重或无水碘酸的失重,也可以用碘量法测定释放出的碘单质来计算氧的质量分数。
同样的,用银制容器(银舟、银制胶囊)包裹的精确称量的标准物质或被测样品被元素分析仪的自动进样盘带入裂解反应管中,在氦气气氛和约1150℃的高温下,在裂解反应管中形成的氧自由基与裂解反应管中填充的碳粉生成CO。酸性裂解产物H2S、HCN和HCl等被接在裂解反应管后的吸收管中的碱石棉吸收,在吸收过程中产生的H2O则被吸收管中填装在碱石棉后的干燥剂吸收。中性的裂解产物CH4、H2和N2与CO一起载入分离系统和检测系统。在40℃时,CO被特殊的吸附解吸柱吸附,其他混合气体直接进入热导检测器,在这些混合气体被检测到以后,吸附解吸柱开始加热至260℃,使CO解吸出来,从而进入热导检测器进行测定。热导池中化学组分变化转化成的电信号和数字信号由计算机进行数据处理。
值得一提的是,利用该法测试的过程中,含氟、磷、碱金属和碱土金属的有机物都会影响氧的测定。氟化物的产生会对测试仪器造成损坏,尤其是石英部分,含碱金属和碱土金属的有机物的裂解则容易腐蚀损坏裂解反应管,因而在测试过程中应注意。
3.3 氮元素分析
作为有机物中最常见的元素之一,氮元素的定量分析也十分常见。通常会将有机物中的氮转化成氮气或氨气的形式,然后进行间接测定。
最常见的方法有杜马法和克达尔法[3]。杜马法主要针对难分解的物质,以气量法或气相色谱法测定产生的氮气;克达尔法则主要针对于胺类,常采用容量法或分光光度法测定生成的氨气。
对比来说,前者设备复杂,应用不多,但适应面广,常在克达尔法测定结果可疑时用以核对结果;后者设备较为简单,操作不太复杂,准确度也较高,应用最多,但只能测定氨基氮,对于氧化态氮则不能直接测定,须还原后才能用此法测定。
以克达尔法为例,其测定原理如下:

首先将样品用浓酸(如硫酸)消化,并加入适当的催化剂(如汞、乙酸汞、硫酸钾、硫酸铜等),氮被还原为氨,并以铵盐形式存在于溶液中。然后将消化液碱化,进行水蒸气蒸馏,氨即随水蒸气蒸出,蒸馏液通入弱酸溶液(如硼酸)中。氨全部蒸出后即可用标准酸溶液滴定,求出氨的量,再换算成氮即可。吸收液也可用稀碱标准溶液,以标准酸溶液滴定过剩的碱。
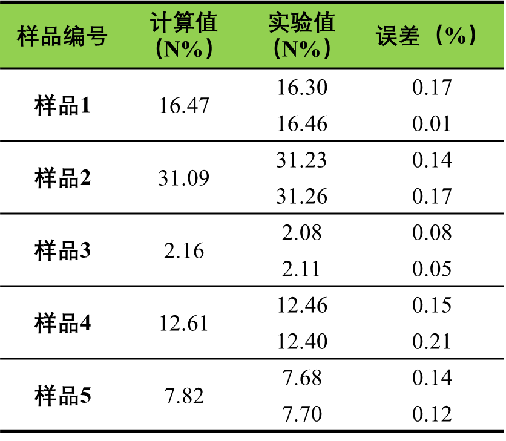
表2 有机物中氮元素的测定结果
如上表2所示,沙逸仙等人[4]利用氧化钴作为催化剂,测试了一系列有机物中氮元素的含量,极小的误差证明了该法的先进性。
3.4 硫元素分析
硫元素存在于许多有机物中,有机硫含量的分析已从原有的化学分析法发展到如今的色谱法、电位滴定法等多种仪器分析方法。尽管仪器分析凭借其操作的简便性、结果的准确性迅速普及到化学分析的各个领域,氧瓶燃烧-高氯酸钡滴定法对于有机物中硫含量的测定仍具有测定方法成熟、结果可靠、成本低廉的特点,因此作为一种经典的测硫法至今仍被广泛运用。利用该方法可以测定硫的质量分数,测定范围为硫的绝对质量0.3~5.5 mg,样品可以为液体或固体。因此,此方法广泛适用于化学、化工、医药、石油、地质、农业、食品、环保等各领域。
此法的基本原理如下:
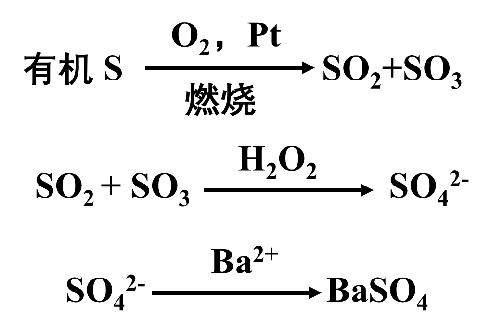
含硫有机物在密闭的充满氧气的锥形瓶中,在Pt的催化下燃烧分解后,以H2O2水溶液吸收并氧化燃烧生成的SO2与SO3,使之转化为SO42-,并以偶氮氯膦为指示剂,用高氯酸钡标准溶液滴定生成的SO42-。
刘延敏等人[5]利用氧瓶燃烧-高氯酸钡滴定法与分光光度法联用,对制备的有机物样品的硫含量进行了测定。如表3所示,各个不同样品中,硫含量测定的相对标准偏差均

表3 不同有机样品中硫含量的测定
3.5 磷元素分析
有机微量定量分析中测定磷的含量时,通常先将有机物氧化分解,使有机物中的磷转变为正磷酸根,然后选择适当的方法进行定量测定。含磷有机物的氧化分解方法主要有过氧化钠弹筒熔融法、封管分解法、碱熔和在Kjeldahl烧瓶中湿法分解等[6]。
在上述氧化分解方法中,目前广泛使用的是湿法消解法,此方法操作较简单,而且分解效果较好。据文献报道,用于湿法分解的试剂有浓硫酸-硝酸、高氯酸、高氯酸-硝酸等混合酸,然而这几种酸或混合酸在使用时均有一些限制,如浓硫酸-硝酸混合液并不适用于所有的有机物,表现为对于一些难溶的有机物,如膦、磷酸盐(含C-P键)等,浓硫酸-硝酸混合液并不能将它们完全分解。常用的硝酸虽然其氧化性能非常好,但在氧化完成后,赶尽硝酸的条件难以掌握,为此,需要对氧化剂进行重新选择。
而其中,高氯酸作为一种有效的强氧化剂,可以使很多结构复杂、难分解的物质氧化分解。虽然一般认为单独使用高氯酸进行分解时容易引起爆炸,很危险,但是在进行有机磷测定时,所用的样品质量较少,加入高氯酸的量很少,不会产生爆炸的风险,所以实验是安全的。高氯酸-硝酸混合液可以用于氧化分解很多难溶的有机物,包括生物大分子,但是硝酸的存在会干扰测定,因此在分解时必须驱赶完全,然而二次蒸煮法使分析时间增长,而且硝酸的存在可能会引起空白值的增大。
含磷有机物经过氧化分解后,磷的微量定量分析方法主要有重量法、容量法和比色法等,最常见的是比色法。用比色法进行测定具有快速、简单、适用范围广等优点。通常所用的比色法有两种,一种是钼蓝比色法,另一种是磷钒钼黄比色法。对于实验室测量,由于样品的量较少,因此磷钒钼黄比色法更具优势,使用范围更加广泛。
3.6 卤元素分析
随着有机化学的不断发展,有机物中氟、氯、溴碘等卤元素的微量定量分析在天然有机化学、药物化学、生物化学、材料化学以及石油化工等许多领域扮演着越来越重要的角色,分析方法也逐渐丰富,从原先的沉淀PbCIF-Volhard滴定法发展到后来的分光光度法、EDTA返滴定法、荧光法、选择性电极法、直读光谱法、NMR法、AAS法、稀土金属盐滴定法、零点电位滴定法和石英氧瓶燃烧-硝酸钍滴定法等[7]一系列测定方法。
事实上,对不同的卤素的定量分析方法大同小异,比如对有机物中氯和溴元素的测定通常采用氧瓶燃烧-银电量法和氧瓶燃烧-硝酸汞滴定法,对有机物中碘元素的测定则通常采用氧瓶燃烧-碘量法或氧瓶燃烧-电位滴定法,而对有机物中氟元素的则通常采用氧瓶燃烧-硝酸钍滴定法。
以氧瓶燃烧-硝酸钍滴定法为例,其基本原理如下:
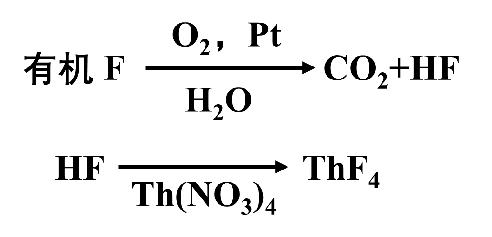
氟有机物在氧瓶中燃烧分解后,以水吸收生成的氟化氢或氟硅酸,在一定的酸度下,以甲基百里酚蓝为指示剂,用硝酸钍标准溶液滴定,生成四氟化钍沉淀。尽管目前仪器分析凭借其操作的简便性、结果的准确性迅速普及到化学分析的各个领域,氧瓶燃烧-硝酸钍滴定法对于有机物中氟含量的测定仍具有测定方法成熟、结果可靠、成本低廉的特点,因此作为一种经典测氟法至今仍被广泛运用。
3.7 微量及痕量金属元素分析
除了上文提到的常见有机元素,在有机元素的定量分析中,事实上还包括一些微量或痕量的金属或非金属元素,对此类元素的测定目前常使用原子吸收分光光度法,该方法可用于多种金属元素和少数非金属元素的测定。
火焰原子吸收分光光度法一般可分析ug/mL级的元素,检出限在10-4~10-2μg/mL,石墨炉原子吸收分光光度法的绝对检出限可达10-10~10-12 g,对于有些元素检出限甚至更高。原子吸收分光光度法具有选择性好、灵敏度高、实用性强、精密度高等特点,现已广泛用于冶金、地质、材料、采矿、石油、轻工、农业、医药、卫生、食品及环境监测等领域的微量及痕量金属与部分非金属元素的分析。
此外,电感耦合等离子发射光谱法(ICP-OES法)也是可行的选择。该方法用于多种金属及非金属元素的同时或顺序测定,进样方式为溶液进样。与常用的原子吸收分光光度法相比,它的运行成本较高,氩气消耗大,但是它有诸多优点,如测定元素范围广、线性范围宽(可达5~6个量级)、化学干扰少、激发温度高、有良好的检出限、分析精密度高、可进行同时或顺序多元素测定等。因此,电感耦合等离子发射光谱法也有着广泛的应用领域。
4.总结与展望
随着有机化学的发展,数之不尽的有机化合物被合成出来并逐渐进入到人们的生产生活的方方面面,有机物正在发挥着不可替代的作用,对其组成元素的分析既无法忽视,又成为了许多相关科研工作者的研究对象。
有机元素定量分析在天然有机化学、有机合成化学、药物化学、生物化学以及石油化工等各个领域中都占有重要的地位。笔者虽然对常见的有机元素的定量分析方法做了较为详细的归纳总结,然而,由于有机物的复杂性,实际测试中往往需要多种测试方法协同使用,且测试时不同元素之间亦有可能存在干扰作用,因此,具体情况应具体分析。
此外,随着科学技术的飞速发展,在科研人员的不懈努力下,相信在不远的未来,完全智能化的全自动元素分析测试技术或仪器将带来有机元素定量分析领域的革新!
5.参考文献
[1] 戴俪婧, 高敏, 张剑锋等. 理化分册 (化学分册), 2012, 48: 926.
[2] Ma T S, Rittner R C. Modern Organic Elemental Analysis. Marcel Dekker, Inc. New York, 1979, 128.
[3] Dumas J B. Annales de Chimie, 1833, 53 (2): 164.
[4] 沙逸仙, 王昌益. 有机化合物中氮的快速微量测定法, 化学学报. 1954, 30, 513-518.
[5] 刘延敏, 段漓童. 有机化合物中硫的微量测定, 华北煤炭医学院学报. 2006, 05, 635-636.
[6] Kirsten W J, Carlsson M E. Microchemical Journal, 1960, 4, 3.
[7] Lemieux P E, Black R H. Analytical Chemistry, 1960, 32, 246.

