复合蛋白锌硒宝片(蛋白锌硒宝片有什么功效)
撰文:旧岛望月亮
IF=54.908
推荐度:⭐⭐⭐⭐⭐
亮点:
1.得到了一种高稳定性的新型绿色荧光蛋白
2.将该蛋白用于荧光成像,揭示了内质网的形态学变化和SARS-CoV-2的组装过程。

由于转基因和蛋白靶向技术的进步,科研人员可以利用荧光蛋白对细胞器、细胞骨架等亚细胞成分进行活体观察。然而从低表达的样本中获得高信噪比的图像需要强激发光,后者往往会产生严重的光漂白现象。2022年4月25日RIKEN脑科学研究中心Atsushi Miyawaki等人从水母体内提取到了一种新型荧光蛋白,其良好的光稳定性能降低光漂白现象并实现在一定时间内的超分辨率成像。其研究结果发表在名为”A highly photostable and bright green fluorescent protein”的文章中。

Cytaeis uchidae水母属于刺胞动物门水螅纲,其生殖腺以及上下伞面的上皮细胞能产生绿色荧光(图1a-d)。对Cytaeisuchidae水母进行RNA测序,作者发现并命名了编码荧光蛋白的转录因子CU17S。将其cDNA植入大肠杆菌形成暗绿色荧光菌落后再提取出来,发现纯化后的CU17S在496 nm处有一个吸收峰(图1f)。而其激发和发射光谱与Cytaeis uchidae水母所产生的荧光相同(图1g)。当CU17S在HeLa细胞中表达时,其绿色荧光主要分布在细胞质和细胞核中。利用宽视野显微镜定性观察发现,尽管CU17S在大肠杆菌或HeLa细胞中的荧光强度不高,但其荧光基本没有光漂白现象。由于荧光的强度和光稳定性之间呈负相关,因此很难在保持CU17S良好的光稳定性的同时提高其荧光强度。作者通过对CU17S的基因进行随机突变(图1e,红),发现V168A突变能促进荧光蛋白的表达和生色团成熟,从而提高CU17S的荧光强度(图1f)。该突变体能在大肠杆菌中大量表达,且CU17S/V168A的激发和发射光谱与CU17S相同(图1g)。由于CU17S/V168A出色的光稳定性和荧光强度,作者将其命名为StayGold。将StayGold和其它四种绿色荧光蛋白(EGFP,SiriusGFP,mNeonGreen和mClover3)的光稳定性进行比较,发现StayGold的荧光强度较高且光稳定性强(图1h)。比较表达上述五种荧光蛋白的HeLa细胞,发现StayGold组的t1/2大于10000秒,说明其具有良好的光稳定性(图1i)。将表达StayGold和mNeonGreen的细胞混合培养并对两组细胞的荧光强度和光稳定性进行比较。结果发现两组细胞的亮度相近,而StayGold组的光稳定性更强(图1j)。
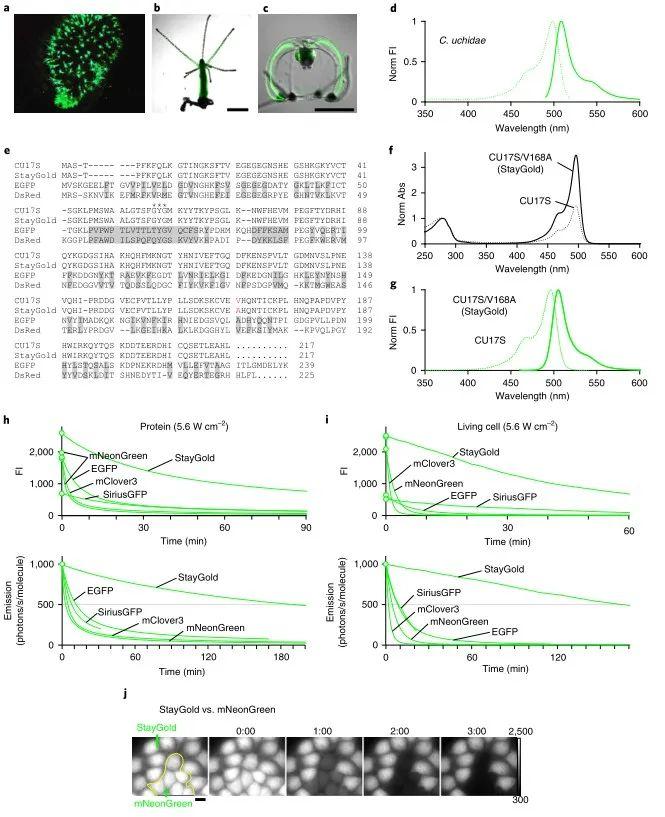
图1 水母荧光蛋白Staygold的光稳定性研究
接着,作者试图在结构照明显微镜(SIM)下用StayGold对内质网(ER)进行高时空分辨率成像。其基本构想是将钙网蛋白和内质网的氨基酸序列分别与荧光蛋白的N端和C端相连接,从而使StayGold和其他荧光蛋白特异性标记内质网腔。然而,上述构想在实际操作中存在两个问题。首先,荧光蛋白的半胱氨酸残基会在内质网中形成的二硫键从而阻止β-折叠。因此,作者通过定点随机突变将StayGold的Cys174和Cys208替换成Ile,得到了oxStayGold。光漂白实验表明,上述突变不会影响StayGold的光稳定性(图2a)。并且,与现有的15种荧光蛋白相比,StayGold表现出良好的光稳定性(图2b)。其次,由于StayGold的氨基酸序列较短(图1e),这使得StayGold对N端和C端与其它序列的连接较为敏感。因此,作者将EGFP荧光蛋白N端的9个氨基酸和dfGFP荧光蛋白C端的10个氨基酸融合到了StayGold中,从而提高其靶向能力。与er-oxGFP 相比,根据上述原理改造后的er-(n2)oxStayGold(c4)的光稳定性更强(图2c)。
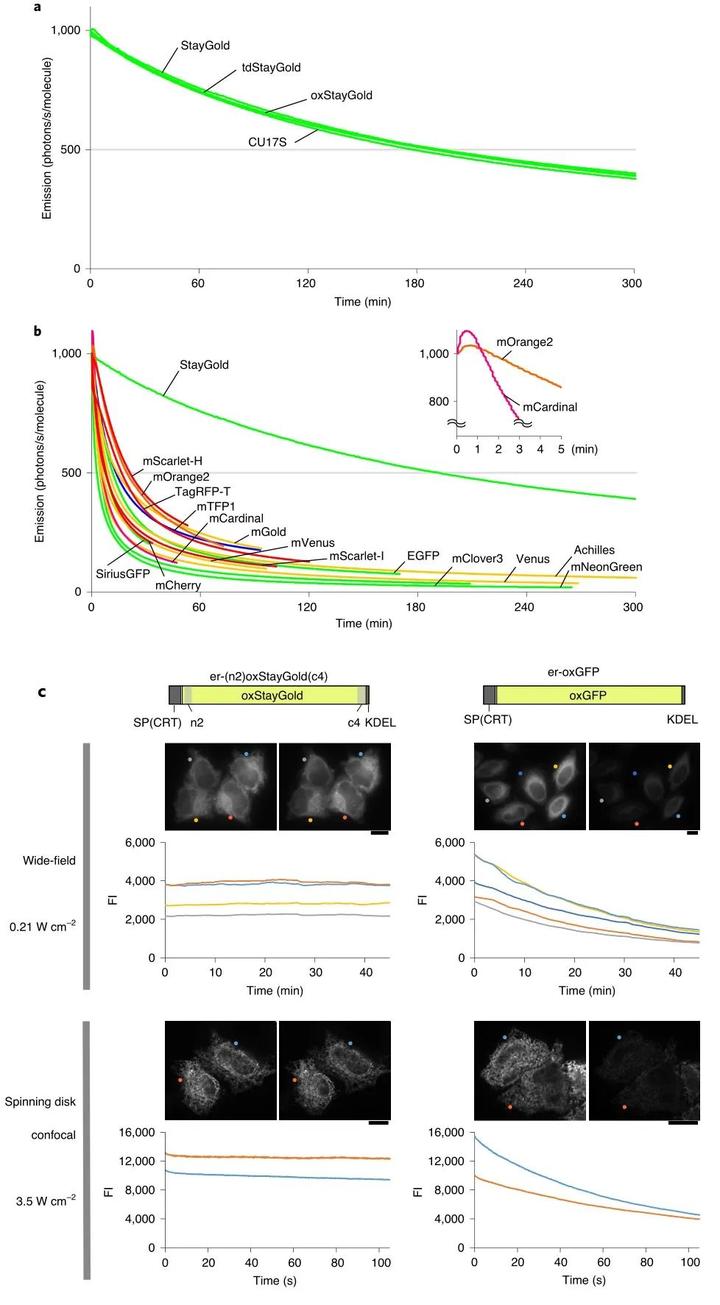
图2 靶向ER腔的Staygold的光稳定性
三维结构照明显微镜(3D-SIM)作为一种活细胞成像技术,能在焦平面上方和下方激发荧光团,同时实现光学切片。由于其每帧可获得15张(五个相位三个角度)图像,3D-SIM对染料的光稳定性要求很高,而StayGlod恰好能满足它的这一需求。为了深入研究内质网的形态学问题,作者获得了表达er-(n2)oxStayGold(c4)的HeLa细胞的单层3D-SIM图像(图3a和b)。然后进行了全自动图像处理,并设计了一种算法来量化图像每个区块中内质网小管的位移。实验结果表明,内质网靠近细胞膜的部分流动性更强。而当肌醇1,4,5-三磷酸诱发Ca2+释放时,内质网几乎呈静止状态(图3d和e)。上述结果表明,3D-SIM与StayGold相结合能较好的对内质网进行高时空分辨率成像。
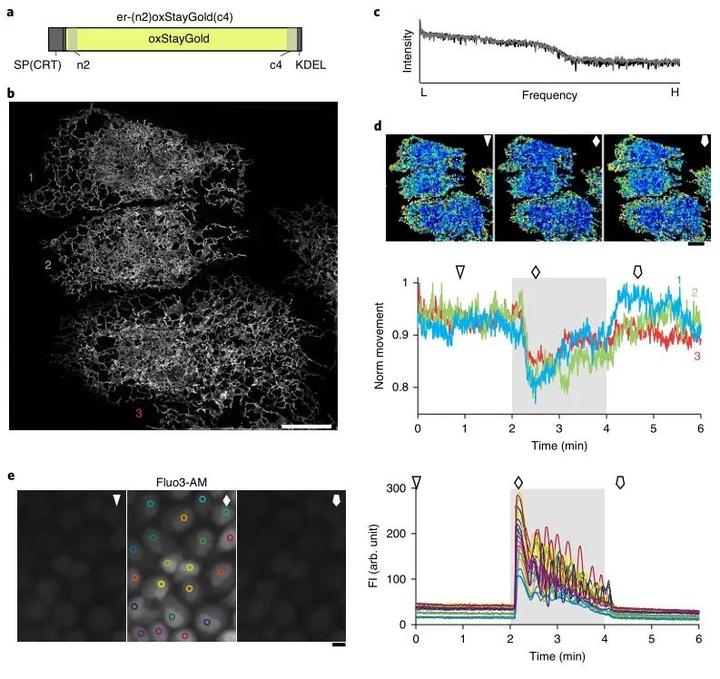
图3 通过快速、持续、宽3D-SIM揭示由激动剂诱导和拮抗剂诱导的ER结构纵向变化
然后,作者试图通过改造StayGold揭示SARS-CoV-2的组装过程。该病毒表达的突刺糖蛋白(S蛋白)由S1和S2亚基组成,能促使病毒进入宿主细胞。在针对S1蛋白开发的中和抗体中,作者选择了纳米抗体(Nbs)与StayGold荧光蛋白相结合。从cDNA文库中筛选得到了具有高亲和力的结合蛋白Nb(S1)。通过在Nb(S1)和StayGold之间插入EV linker,得到了Nb(S1) = = StayGold(图4a)。作者根据该方法获得了高产量和高效纯化的重组嵌合蛋白,并且用实验证实了StayGold生色团的成熟(图4b)。SDS-PAGE结果证实了改造后荧光蛋白的完整性,而表面等离子体共振实验表明Nb(S1) = = StayGold对S1的亲和力略低于Nb(S1)(图4c和d)。
使VeroE6细胞表达TMPRSS2,后者可以通过切割S蛋白促进病毒进入细胞。将感染SARS-CoV-2的VeroE6/TMPRSS2细胞固定,与Nb(S1) = = StayGold进行免疫反应后在显微镜下观察到了带有绿色荧光的细胞(图4e)。并且实验表明只有当感染SARS-CoV-2的细胞与Nb(S1) = = StayGold发生免疫反应后才会出现荧光信号(图4f)。利用高空间分辨率的3D-SIM进行观察,发现SARS-CoV-2的S蛋白呈环状(图4g)。而在细胞膜上发现的S蛋白说明病毒是通过细胞膜释放到细胞外的(图4h)。为了进一步表征S蛋白的组装过程,作者分别用ERGIC3、nsp8和dsRNA抗体与ERGIC-SMVs、CMs和DMVs相结合*,并用红色荧光标记了(Alexa Fluor 555)它们的位置(图4i-k)。结果发现S蛋白和ERGIC3之间存在大量重叠,说明其主要的组装场所为内质网-高尔基中间隔室。
*已有研究表明SARS-CoV-2能改变宿主细胞的内膜系统,诱导内质网形成CMs和DMVs。前者能累积病毒非结构蛋白(nsps)促使其重组宿主细胞膜形成DMVs,而后者是病毒复制的主要场所。此外,已有实验表明内质网-高尔基中间隔室(ERGIC)是病毒组装的主要场所。
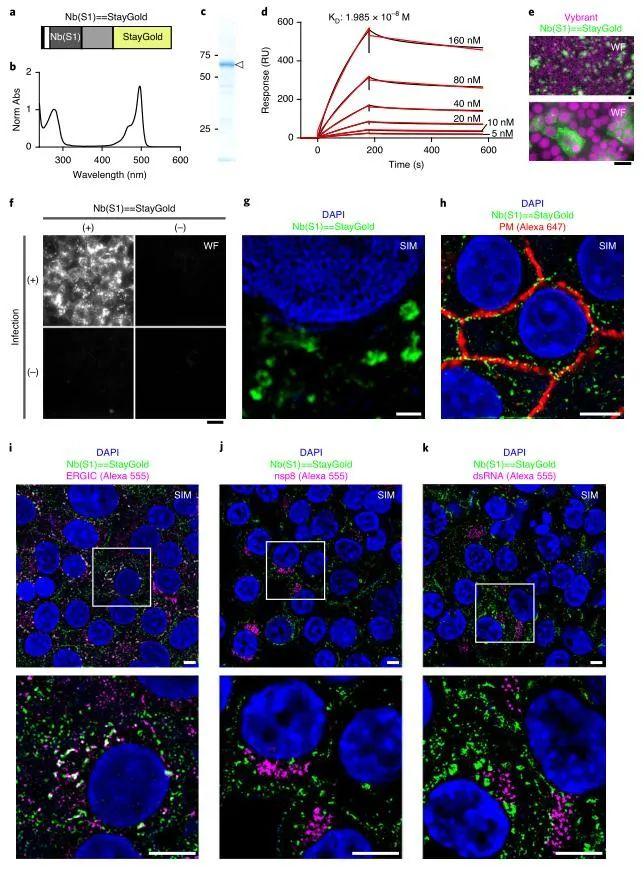
图4 StayGold和SIM揭示SARS-coV-2在细胞中的组装
该文章从Cytaeis uchidae水母中发现了编码荧光蛋白的CU17S。为了在保证稳定性的前提下提高荧光强度,作者促使其发生基因突变,并将突变后的CU17S命名为StayGold。与现有的绿色荧光蛋白相比,其光稳定性更强且荧光强度与mNeonGreen相近。利用3D-SIM和改造后的StayGold对内质网和SARS-CoV-2的S蛋白成像,揭示了内质网的形态学变化以及SARS-CoV-2的组装过程。此外,作者表示er-(n2)oxStayGold(c4)与GI-SIM等快速超分辨率成像方法相结合能进一步提高成像过程的持续时间,从而更好地研究细胞内结构的动力学。
教授介绍

KazuhikoKatayama为日本RIKEN脑科学研究中心研究员,于1973年获得Keio大学博士研究生学位。他曾任大阪大学、东京大学教授,并于2019年任上海科技大学教授。Kazuhiko Katayama所在课题组的研究方向为细胞钙信号,主要研究脑内钙信号、细胞分化中的钙信号、IP3受体的结构和功能、IRBIT的功能及其机制。其成果发表在Nature、Science、Cell等期刊上。
参考文献
Hirano, M., Ando, R., Shimozono, S. et al.A highly photostable and bright green fluorescent protein. Nat Biotechnol(2022)./10.1038/s41587-022-01278-2

