细胞中的微量元素(细胞中微量的元素)
在当下,全世界范围内的癌症率呈现出逐年上升的态势。值得注意的是,代谢改变是肿瘤组织的标志之一,由于代谢活动增加、线粒体功能障碍以及肿瘤微环境的影响,多种癌症表现出高活性氧(ROS)的特征。
为了防止活性氧(ROS)对自身造成损伤作用,癌细胞通过某些应激反应和激活抗氧化机制,如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPXs)、硫氧还蛋白和过氧化氢酶等,以此清除细胞内积累过多的活性氧(ROS)。
因此,肿瘤细胞的活性氧(ROS)清除系统的代谢酶是一个十分有治疗潜力的药物靶点。
近日,美国麻省大学医学院的研究人员在 Nature Metabolism 杂志上发表了题为:Selenium detoxification is required for cancer-cell survival 的研究论文。
该研究正证实硒半胱氨酸生物合成途径中的代谢酶——SEPHS2,具有硒解毒作用,而这一解毒作用是癌细胞生存所必须的。
通过抑制SEPHS2,进而扰乱肿瘤组织中的硒利用,最终导致癌细胞因硒中毒而死亡。

硒蛋白(selenoprotein),普遍认为是一类含有硒元素的蛋白,大部分硒蛋白参与清除活性氧(ROS)和维持细胞稳态,如谷胱甘肽过氧化物酶(GPXs),催化中心的硒半胱氨酸是其活性维持的关键。
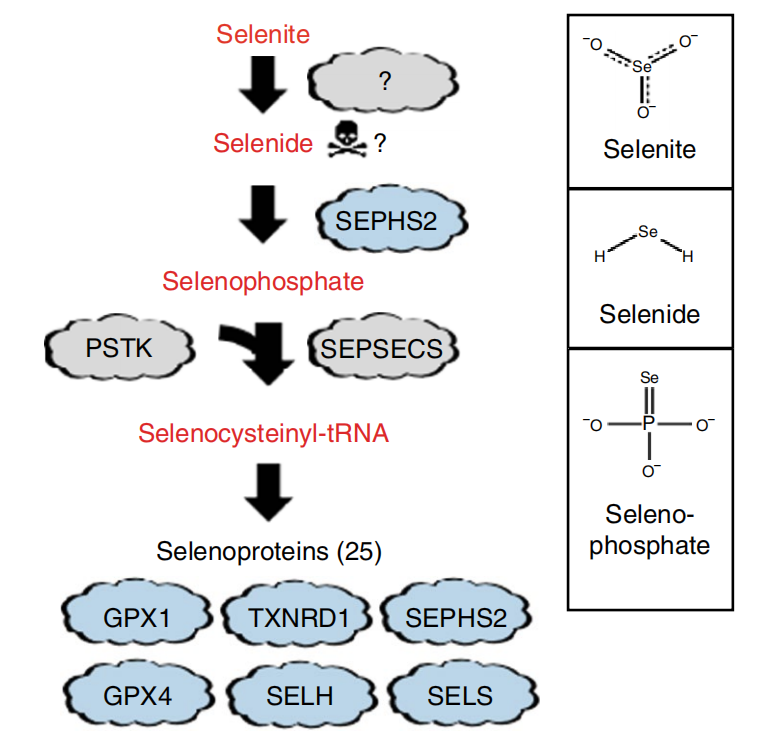
硒半胱氨酸是一种稀有氨基酸,其结构与半胱氨酸类似,只是硫原子被硒取代。硒磷酸合成酶2(SEPHS2)以ATP依赖的方式从含硒化合物中生产硒磷酸盐,后者则是 O-磷酸丝氨酸tRNASec转移-RNA合成酶(SEPSECS)的底物,从而合成硒半胱氨酸。
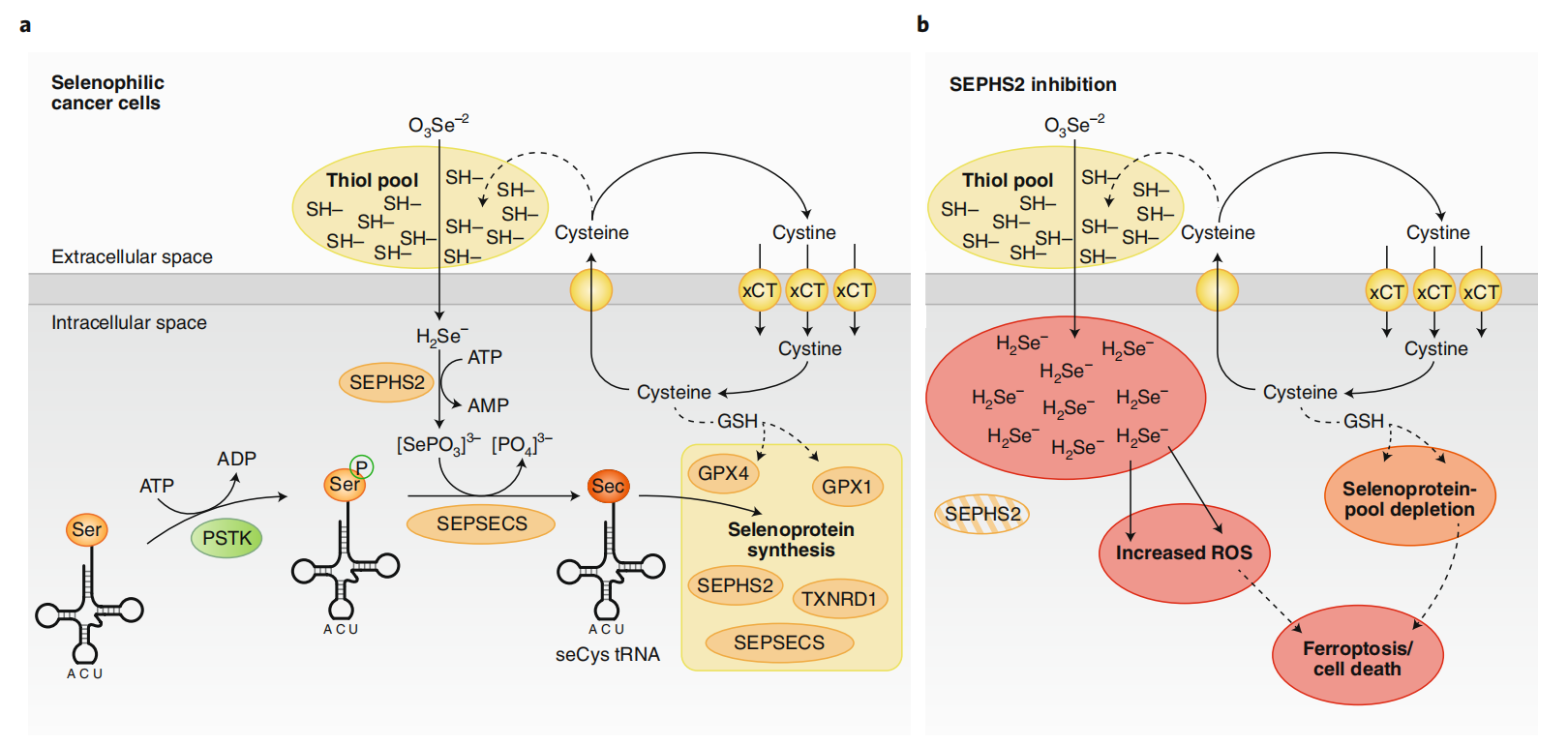
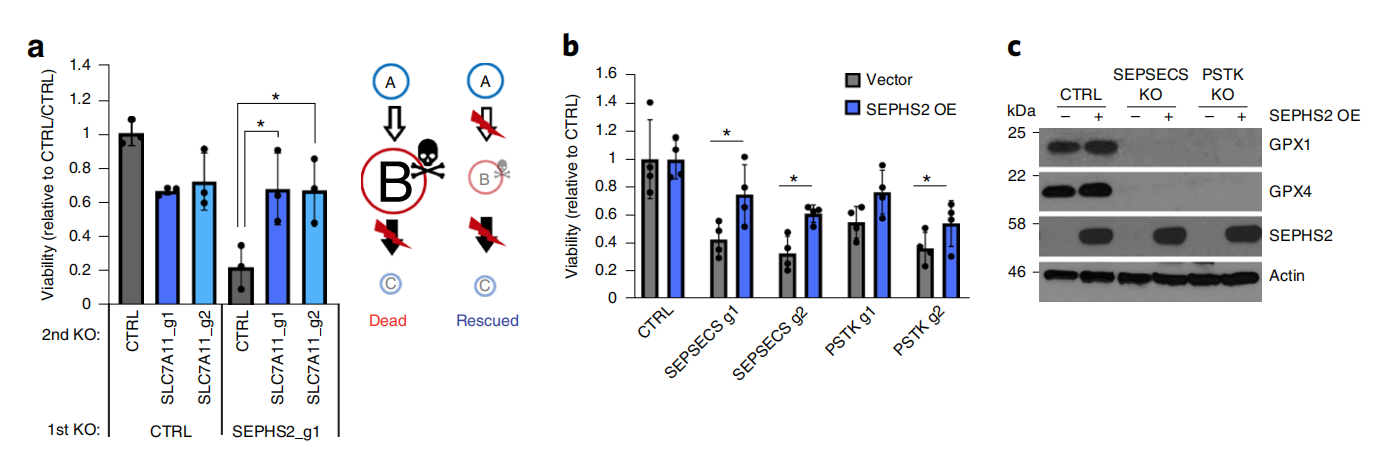
在这项研究中,研究团队通过CRISPR-Cas9基因编辑技术敲除已知的解毒酶,进一步筛选分析后,研究小组将研究重点聚焦于SEPHS2。
之前的研究表明SEPHS2敲除的乳腺癌细胞生长速度减缓,此外,在人类乳腺癌样本中SEPHS2高表达,而这一状况往往与较差的临床结果有关。这意味着SEPHS2可能是一个重要的肿瘤治疗靶点。
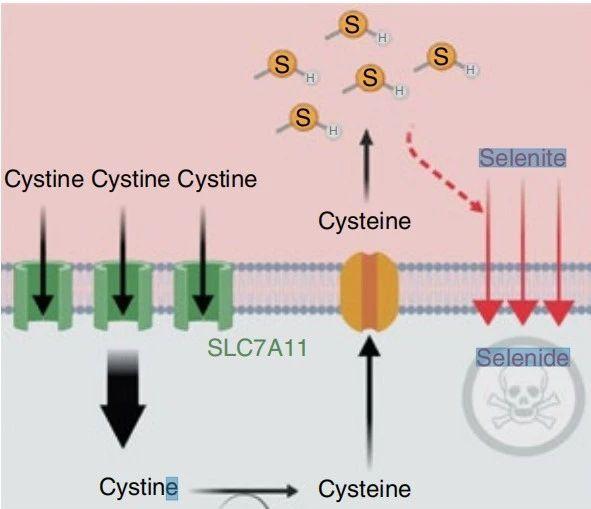
研究团队推测,SEPHS2的抑制将导致其底物硒化物的毒性积累。值得注意的是,嗜硒癌细胞提高了SLC7A11基因的表达,这促使癌细胞依赖SEPHS2进行硒化代谢和解毒。事实上,SLC7A11基因的敲除抑制了细胞内硒的积累,并拯救了SEPHS2敲除细胞。
这一机制巧妙地将半胱氨酸生成、硒代谢解毒和硒蛋白合成串联起来,从而产生极高的活性氧(ROS)清除效率。
因此,这一通路的解偶联,即以其中的关键代谢酶作为靶点将为肿瘤治疗提供一个新机会。
除此之外,研究小组还发现,铁死亡抑制蛋白1(FSP1)可能在这一过程中发挥着重要作用,因为,FSP1的敲除可以使非恶性细胞对SEPHS2抑制和铁死亡敏感,但这一反应并没有在本研究处理的癌细胞系中转化。

硒是一种化学元素,化学符号是Se,在化学元素周期表中位于第四周期VI A族(第34号元素),是动物和人类的一种必需微量元素。与机体内的氧化还原代谢反应密切相关。嗜硒的癌细胞可以从循环系统中吸收硒,广泛的临床研究表明,含有维生素和抗氧化剂的膳食会降低癌症治疗效果,并与较差的患者预后相关。
总而言之,此项研究表明硒磷酸合成酶2(SEPHS2)在乳腺癌等多种癌症中高表达,在硒蛋白的合成代谢中发挥重要作用,SEPHS2的抑制会扰乱肿瘤组织的硒利用和活性氧(ROS)清除,最终导致癌细胞的死亡。
论文链接:

