甲癌术后能否补硒(甲癌术后能吃硒酵母吗)
点击上方“中国实用外科杂志” 可以订阅哦!
王 宇教授
【引用本文】王 宇,渠 宁,魏文俊,等. 甲状腺髓样癌术后复发处理原则[J]. 中国实用外科杂志,2021,41(8):874-877.
甲状腺髓样癌术后复发处理原则
王 宇,渠 宁,魏文俊,嵇庆海
中国实用外科杂志,2021,41(8):874-877
摘要
甲状腺髓样癌(MTC)具有初治后易局部复发、区域淋巴结侵犯和肺、骨等远处转移的倾向,预后相对较差。国内临床实践中,对于该类病人术后随访评估方案及处理原则等问题仍然存在争议与分歧。结合国内外指南共识及笔者中心相关研究结果,建议局部复发且有明确病灶者以手术治疗为主,而无法手术或远处转移的病人则强调围绕基因靶点的个体化全身治疗。
通信作者:王宇,E-mail:
甲状腺髓样癌(medullary thyroid carcinoma,MTC)恶性程度位于甲状腺未分化癌与分化型甲状腺癌之间,具有早期侵犯区域淋巴结和向肺、骨等远处转移的倾向,预后相对较差。MTC 的低发病率导致其综合研究较难,迄今为止的大多数研究都是主要基于单一机构、回顾性和(或)非随机研究。2020年,中国医师协会外科医师分会甲状腺外科医师委员会等4家学术组织联合发布了《甲状腺髓样癌诊断与治疗中国专家共识(2020版)》[1](以下简称2020版中国共识),该共识参考了2013年后国外现有的各大临床指南并在此基础上加入国内文献和证据。尽管如此,在持续或复发性髓样癌的处理及管理方面,国内尚缺乏相关报道或尚未临床普及,各地区实践模式仍然存在显着差异。本文根据笔者中心相关研究的最新数据及相关专家共识和指南,阐述MTC术后复发的处理原则。
1 2020版中国共识关于MTC初次手术疗效及复发风险评估原则
MTC初次手术后,应对病人的手术治疗效果和复发转移风险进行评估,以便制定进一步的治疗随访计划。2013年Tuttle等[2]仿照分化型甲状腺癌(DTC)提出MTC的动态复发风险分层,将MTC初次术后的病人分为4类:(1)生化治愈。手术完整切除肿瘤,血清降钙素(Ctn)降至检测水平以下。(2)解剖治愈。肿瘤标记物[Ctn和癌胚抗原(CEA)]水平升高,但无影像学可见病灶。(3)解剖残留。持续存在的解剖残留或远处转移。(4)疾病状态不确定。非特异的影像学异常、生化异常或无法检测的解剖残留。由此可见,除生化治愈外,其他MTC病人初次术后体内仍存肿瘤活性,成为不良预后的潜在危险因素。文献报道,生化治愈的病人10年生存率为95%~97%[3],而Ctn水平持续升高的病人5年和10年生存率却分别为80%~86%和70%[4],这也印证了MTC的预后主要与病人初次手术切除效果有关的假设。
对于MTC而言,无论是术前诊断还是术后判断复发转移,Ctn的灵敏度和特异度都是最高的,国外一项研究结果指出,Ctn水平>1000 ng/L与中位直径2.5 cm的肿瘤密切的相关。CEA水平也被证明可预测肿瘤负荷,CEA 水平>30 μg/L提示中央及颈侧区淋巴结受累可能。虽然Ctn水平通常在复发病人中显著升高,但这并非绝对。即使具有大量的隐匿性肿瘤,分化差的MTC病人可能不会表现出Ctn水平升高。当全身症状与快速进展的转移性疾病(即恶病质、虚弱)或 CEA 水平过高而Ctn水平正常至低水平不成比例时,应怀疑此类病人。但同时2020版中国共识强调了术后持续性Ctn水平升高并不一定提示肿瘤复发,惟有进行性升高的Ctn水平才提示MTC术后的复发转移事件。对于术后Ctn及CEA水平持续升高,或降至正常后再次升高的病人,应计算 Ctn水平倍增时间,应至少连续检测4次,每次间隔至少6个月。一项回顾性研究指出,80%以上的病人两项生物学指标的变化趋势一致,倍增时间与病人生存率成正比,当倍增时间>24个月时,在研究结束时病人均存活[5]。因此,术后Ctn 和CEA水平高于正常范围的病人应进行影像学检查积极寻找持续或复发病灶,影像学检查的肿瘤复发病灶定位应从通过超声仔细检查颈部。如果发现局部疾病的证据,可以进行细针穿刺活检以确认诊断。CT、MRI或正电子发射断层成像(PET) 可用于进一步描述局部肿瘤并寻找远处病灶。核医学显像方面,99mTc-亚甲基二膦酸盐(99mTc-MDP) 骨显像可用于骨转移灶的排查。另外,当生物学指标倍增时间缩短时,18F-氟脱氧葡萄糖(18F-FDG)正电子发射型计算机断层显像(PET-CT)、18F-多巴(18F-DOPA)和 68Ga-生长抑素受体显像也可用评估MTC病人的复发或转移。笔者中心核医学团队在2014及2018年的研究分别指出,对于复发性的MTC病人,尤其是当Ctn水平>1000 ng/L时,18F-FDG PET-CT具有优良的敏感度和特异度,推荐用于检测转移性MTC[6];亲肿瘤显像剂99mTc(V)-DMSA与生长抑素受体显像剂99mTc-联肼尼克酰胺(99mTc-HYNIC)-奥曲肽(TOC)在定位MTC术后复发和转移灶相比,前者具有较高的灵敏度,更优于后者[7]。综上所述,复发性MTC病人术后处理流程见图1。
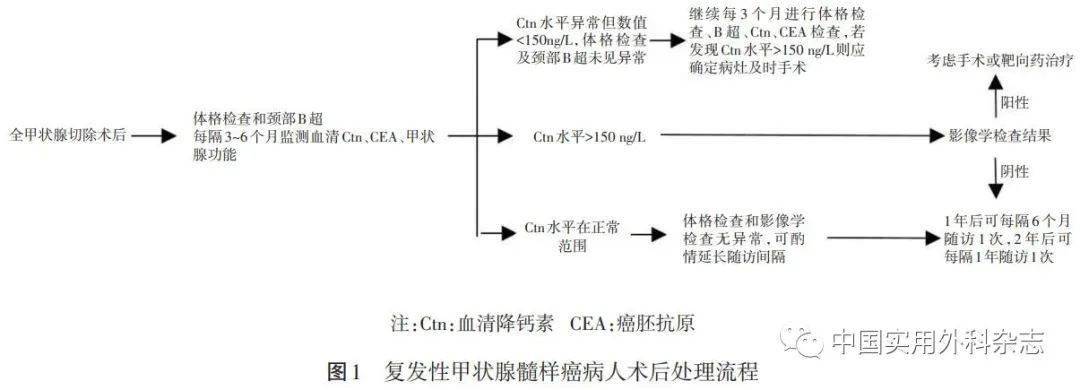
2 MTC术后复发的外科处理原则及笔者中心手术经验
如果发现颈部有复发性病灶,则应尽可能进行再次手术,目的是消除所有残留的病灶。这些手术可能会使生存获益并预防颈部复发病灶导致的致命并发症的发生。转移性肿瘤引发的全身症状(即疼痛、潮红和腹泻)病人可能受益于姑息性肿瘤减灭手术。在以治愈为目的行颈部再次手术之前,需要进行充分检查以评估肺、肝和骨骼等处可能的转移病灶,且应进行喉镜检查以评估声带功能。对于无远处转移的病人,有经验的头颈外科或甲状腺外科医生,可以为局部疾病再手术后多达1/3的病人带来长期肿瘤控制和生化治愈。
颈部原发灶或区域淋巴结(Ⅵ区或颈侧区Ⅱ~Ⅴ区)的再次手术或许会伴有术后并发症发生风险,包括喉返神经损伤、甲状旁腺功能减退或胸导管损伤导致的乳糜漏、颈内静脉、颈总动脉的损伤。必须在充分评估基础上,平衡手术带来损害及获益。由于甲状旁腺体积小且存在初次手术的未知损伤,再次手术时喉返神经损伤的风险可达8%,并且甲状旁腺功能减退的发生率较初次手术后也高达4倍,对于儿童来说,甲状腺床及中央区再手术后上述并发症发生的危险则更高。基于这些相关风险,更支持Ctn水平升高但没有影像学证据的病人不应接受手术,因此类盲目手术根治不彻底、生化缓解率极低。故这些病人应行影像学检查,以寻找任何复发性疾病的证据并确定所在解剖部位。
3 术后复发且无法手术的MTC处理原则
3.1 局部处理原则 手术切除仍是MTC治疗的主要方式,但复发病例一旦为局部晚期则R0切除的机会极低,且需要付出多种器官功能丧失的代价,但术后放射治疗已被证明可改善此类病人的局部控制,包括残留病变、侵袭病灶和受累淋巴结。因此外照射可用于局部残留、晚期疾病和局部姑息的减症治疗[10]。与此同时,适当的外照射有助于缓解局部症状并提高病人的生存质量,因此可应用于转移性MTC的姑息治疗,例如疼痛性骨转移、纵隔或肺部转移引起的呼吸困难或咯血症状、保护颈部重要结构等。
3.2 全身系统治疗 由于滤泡旁细胞不依赖促甲状腺激素(TSH)且无碘摄取,因此对于术后复发或远处转移的MTC而言,DTC相关的TSH抑制治疗、碘治疗等对于该类病人无效。因此全身系统治疗多基于MTC的分子生物学特点,而MTC富集众多基因突变,是系统治疗的潜在靶点。RET基因突变最为常见,且不同突变位点对应不同的临床行为和预后特点。目前国内外指南及2020版中国共识强调了胚系RET检测对于遗传性MTC干预有指导作用。同样,对于散发性MTC,尤其是术后复发的晚期MTC拟施行高选择性RET抑制剂治疗时,其体系RET突变(即肿瘤组织RET突变)也具有指导价值。另一方面,在RET野生型的病人中,18%~80%具有体细胞RAS突变。另外,血管内皮生长因子受体(VEGFR)也在髓样癌肿瘤细胞中高表达,众多酪氨酸激酶抑制剂(TKI)药物涵盖了髓样癌的治疗靶点,并在晚期髓样癌中进行了Ⅰ~Ⅲ期临床试验。目前美国食品和药物管理局(FDA)批准的治疗晚期及转移性MTC的靶向药物有凡德他尼(vandetanib)和卡博替尼(cabozantinib),但这两种药物目前尚未在国内上市。本文撰写时,国内批准有相关适应证的同类药物为安罗替尼(anlotinib)。
值得一提的是,RET是MTC的主要驱动基因,也是治疗MTC潜在最有效的靶点。2020年,两款高选择性RET抑制剂普拉替尼(pralsetinib,BLU-667)和塞尔帕替尼(selpercatinib,LOXO-292)的问世,为MTC病人带来了全新的靶向治疗选择。
除上述靶向治疗外,包括笔者中心在内针对MTC病人免疫治疗靶点的研究中亦获得了有价值的结果,免疫检查点抑制剂为基础的免疫治疗在晚期MTC中可能具有潜在的临床应用价值[11]。未来在MTC靶向联合免疫治疗方面的前景非常广阔,且已有临床研究正在进行这方面的探索,未来的数据公布令人期待。
但应注意的是,影像学评估病灶稳定、肿瘤负荷小、且Ctn和CEA水平倍增时间>2年的晚期MTC病人,权衡利弊后不应给予系统治疗;而进展性、晚期MTC病人首选加入设计良好的临床试验。
3.3 新辅助靶向治疗 由于系统靶向药物及临床试验均以总体的有效率、无病生存率或总生存率作为研究终点,针对局部晚期不可手术的病人,首先使用靶向药物治疗使得瘤体缩小,进而将不可手术转化为可手术治疗,或能为MTC病人提供更多的“治愈”机会。既往已有个案报道将舒尼替尼(sunitinib)、仑伐替尼(lenvatinib)、塞尔帕替尼(selpercatinib)用于新辅助模式[12-14]。目前有多项针对局部晚期无法手术的MTC病人以靶向治疗作为新辅助治疗切入点的Ⅱ期临床试验正在进行中。
总之,2020版中国专家共识的发布,强调了MTC初次治疗后需要密切有效随访并进行疗效评估,对于术后复发且有明确病灶的病人,外科手术仍是MTC复发的惟一根治性治疗方式。但局部晚期不可手术或转移性MTC是当前MTC治疗中的主要挑战,我国共识强调围绕靶点的全身治疗是其主要的治疗选择,但针对局部晚期不可手术病人新辅助治疗模式的探索,也是今后的研究热点之一。
参考文献
(在框内滑动手指即可浏览)
[1] 中国医师协会外科医师分会甲状腺外科医师委员会,中国抗癌协会甲状腺癌专业委员会,中国研究型医院学会甲状腺疾病专业委员会. 甲状腺髓样癌诊断与治疗中国专家共识(2020版)[J]. 中国实用外科杂志,2020,40(9):1012-1020.
[2] Tuttle RM, Ganly I. Risk stratification in medullary thyroid cancer: moving beyond static anatomic staging[J]. Oral Oncol,2013,49(7):695-701.
[3] Walter MA, Meier C, Radimerski T, et al. Procalcitonin levels predict clinical course and progression-free survival in patients with medullary thyroid cancer[J]. Cancer,2010,116(1):31-40.
[4] Cupisti K, Wolf A, Raffel A, et al. Long-term clinical and biochemical follow-up in medullary thyroid carcinoma: a single institution’s experience over 20 years[J]. Ann Surg,2007,246(5):815-821.
[5] Laure G A, Al G A, Auperin A, et al. Progression of medullary thyroid carcinoma: assessment with calcitonin and carcinoembryonic antigen doubling times[J]. Eur J Endocrinol,2008,158(2):239-246.
[6] Jiang J, Yang Z, Zhang Y, et al. Clinical value of [(18)F]FDG-PET/CT in the detection of metastatic medullary thyroid cancer[J]. Clin Imaging,2014,38(6):797-801.
[7] 李毅,潘禾戎,许晓平,等. (99m)Tc(V)-DMSA与(99m)Tc-HYNIC-TOC显像诊断甲状腺髓样癌术后复发和转移价值的对比研究[J]. 肿瘤影像学,2018,27(3):150-156.
[8] Sun G, Wang Y, Zhu Y, et al. Lymph node metastasis between sternocleidomastoid and sternohyoid muscle in clinically node-positive papillary thyroid carcinoma[J]. Head Neck,2013,35(8):1168-1170.
[9] 王宇,渠宁,史潇,等. 甲状腺髓样癌诊治现状及热点问题思考[J]. 肿瘤预防与治疗,2019,32(6):475-479.
[10] Rowell NP. The role of external beam radiotherapy in the management of medullary carcinoma of the thyroid: A systematic review[J]. Radiother Oncol,2019,136:113-120.
[11] Shi X, Li CW, Tan LC, et al. Immune Co-inhibitory Receptors PD-1, CTLA-4, TIM-3, LAG-3, and TIGIT in Medullary Thyroid Cancers: A large cohort study[J]. J Clin Endocrinol Metab,2021,106(1):120-132.
[12] Cleary JM, Sadow PM, Randolph GW, et al. Neoadjuvant treatment of unresectable medullary thyroid cancer with sunitinib[J]. J Clin Oncol,2010,28:e390-392.
[13] Golingan H, Hunis B, Golding AC, et al. Neoadjuvant Lenvatinib in advanced unresectable medullary thyroid carcinoma: a case report[J]. AACE Clin Case Rep,2019,6(2):e73-78.
[14] Jozaghi Y, Zafereo M, Williams MD, et al. Neoadjuvant selpercatinib for advanced medullary thyroid cancer[J]. Head Neck,2021,43(1):E7-E12.
继续阅读
- 暂无推荐

