肺癌补硒和多肽(肺癌补多肽硒有用吗)
1.VOQUEZNA
申报企业:PHATHOM
适应症:糜烂性食管炎
11月1日,美国FDA批准Voquezna(vonoprazan)用于治疗成人糜烂性食管炎(又称糜烂性胃食管反流病GERD)。Vonoprazan是一款新型钾离子竞争性酸阻滞剂(P-CAB),可以竞争性阻滞钾离子与氢/钾离子ATP酶的结合,从而快速抑制胃酸的分泌。根据Phathom公司新闻稿,Voquezna为30年来首个获FDA批准用于治疗糜烂性GERD的创新疗法。
2.ZITUVIMET
申报企业:ZYDUS
适应症:2型糖尿病
11月3日,美国FDA批准Zituvimet片剂作为饮食和运动的辅助剂,改善2型糖尿病成人患者的血糖控制。Zituvimet是西他列汀(一种二肽基肽酶-4(DPP-4)抑制剂)和盐酸二甲双胍(一种双胍)的固定剂量组合,可作为饮食和运动的辅助药物,改善成人2型糖尿病的血糖控制。
3.FRUZAQLA(呋喹替尼)
申报企业:武田制药
适应症:结直肠癌
11月8日,美国FDA批准黄医药与武田制药共同开发的Fruzaqla(呋喹替尼/fruquintinib)用于治疗特定的结直肠癌患者。
呋喹替尼是一种高选择性、强效的口服VEGFR-1、-2及-3抑制剂,其设计使其激酶选择性更高,旨在尽可能地降低脱靶毒性、改善耐受性及对靶点提供更稳定的覆盖。2018年9月,呋喹替尼在中国获批上市,用于既往接受过氟嘧啶、奥沙利铂和伊立替康治疗的转移性结直肠癌患者,包括既往接受过抗VEGF治疗和/或抗表皮生长因子受体(EGFR)治疗(RAS野生型)的患者。
2023年3月,和黄医药和武田制药达成独家许可协议,在除中国大陆、香港和澳门以外的全球范围内进一步推进呋喹替尼的开发、商业化和生产。本次呋喹替尼在美国获批上市,是和黄医药创新药出海的重要里程碑。
4.ZEPBOUND
申报企业:礼来
适应症:肥胖或超重
11月8日,美国FDA批准礼来的替尔泊肽(tirzepatide)用以使肥胖或超重成年患者减轻体重并保持体重,商品名为Zepbound。
替尔泊肽是全球首款GIPR/GLP-1R双靶点激动剂 ,此前2022年5月获得美国FDA批准用于治疗2型糖尿病(T2DM),商品名为Mounjaro。2022年9月又相继在日本和欧洲获批,上市后放量迅速。根据礼来公布的2023年第三季报财报,替尔泊肽三季度营收达到14亿美元,今年前三季度收入达到29.57亿美元。
除了T2DM和肥胖,替尔泊肽还布局了非酒精性脂肪性肝炎(NASH)、射血分数保留的心力衰竭、阻塞性睡眠呼吸暂停(OSA)、慢性肾脏病(CKD)等适应症,国内针对T2DM和减重适应症已申报NDA。
5.DEFENCATH
申报企业:CORMEDIX INC
适应症:导管相关血流感染
11月15日,美国FDA批准CorMedix公司的DefenCath(牛磺罗定和肝素)导管锁定溶液(CLS)上市,专门用于减少患有肾功能衰竭的成人患者通过中心静脉导管(CVC)接受长期血液透析时发生的与导管相关的血流感染(CRBSIs)。
对于肾功能衰竭患者,血液透析通常通过导管帮助过滤血液中的废物和多余的水。但过滤过程会增加血液感染的风险。DefenCath由抗凝剂肝素和广谱抗菌剂牛磺罗定组成,可以在中心静脉导管不使用时注入,有助于防止中心静脉导管感染的发生。CorMedix公司新闻稿指出,这是FDA批准的第一个也是唯一一个抗菌导管封管解决方案。
6.AUGTYRO
申报企业:BMS
适应症:ROS1阳性的非小细胞肺癌
11月15日,美国FDA批准Augtyro(repotrectinib)用于治疗局部晚期或转移性ROS1阳性非小细胞肺癌(NSCLC)成人患者。Repotrectinib是一款ROS1和NTRK靶向抑制剂,由Turning Point公司开发,2022年BMS以41亿美元收购Turning Point 获得该疗法。在此之前2020年7月,再鼎医药宣布与Turning Point公司达成合作,获得repotrectinib在大中华区的独家开发及商业化权。
7.TRUQAP
申报企业:阿斯利康
适应症:HR+/HER2-乳腺癌
11月16日,美国FDA批准阿斯利康的Truqap(capivasertib)联合 Faslodex(氟维司群)用于治疗激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)局部晚期或转移性乳腺癌患者,这些患者在接受内分泌基础方案治疗过程中或之后疾病复发或进展。Capivasertib是一款具选择性、靶向3种AKT激酶异形体(AKT1/2/3)的腺苷三磷酸(ATP)竞争性抑制剂,2023年6月,FDA授予capivasertib+氟维司群的新药申请(NDA)优先审评资格,不到半年的时间就获得FDA批准,意味着capivasertib将为HR+/HER2-晚期乳腺癌提供强有力的全新治疗选择。
8.RYZNEUTA
申报企业:EVIVE BIOTECHNOLOGY
适应症:中性粒细胞减少症
11月16日,美国FDA批准亿帆医药控股子公司亿一生物(Evive Biotech)自主研发的生物创新药Ryzneuta(通用名:艾贝格司亭α注射液,海外商品名Ryzneuta,中国商品名亿立舒,内部研发代码F-627)上市,用于治疗肿瘤患者在接受抗癌药物后出现的中性粒细胞减少症。根据亿帆医药新闻稿,Ryzneuta是中国境内唯一一款同时在中国、美国获批的长效G-CSF产品,亿帆医药成为国内首家以药品上市持有人(MAH)身份获得美国FDA批准的创新生物药企业。
9.OGSIVEO
申报企业:SPRINGWORKS
适应症:硬纤维瘤
11月27日,美国FDA批准Ogsiveo(nirogacestat)片剂用于需要全身治疗的进展性硬纤维瘤成人患者。硬纤维瘤,也称为侵袭性纤维瘤病或硬纤维瘤型纤维瘤病,是一种罕见的、通常为非恶性的软组织肿瘤,是结缔组织的异常生长。Nirogacestat是一种口服特异性γ-分泌酶小分子抑制剂,通过阻断Notch受体的蛋白水解激活起作用。根据FDA新闻稿,Ogsiveo是首个被批准用于治疗硬纤维瘤患者的药物。
国内获批上市的新药
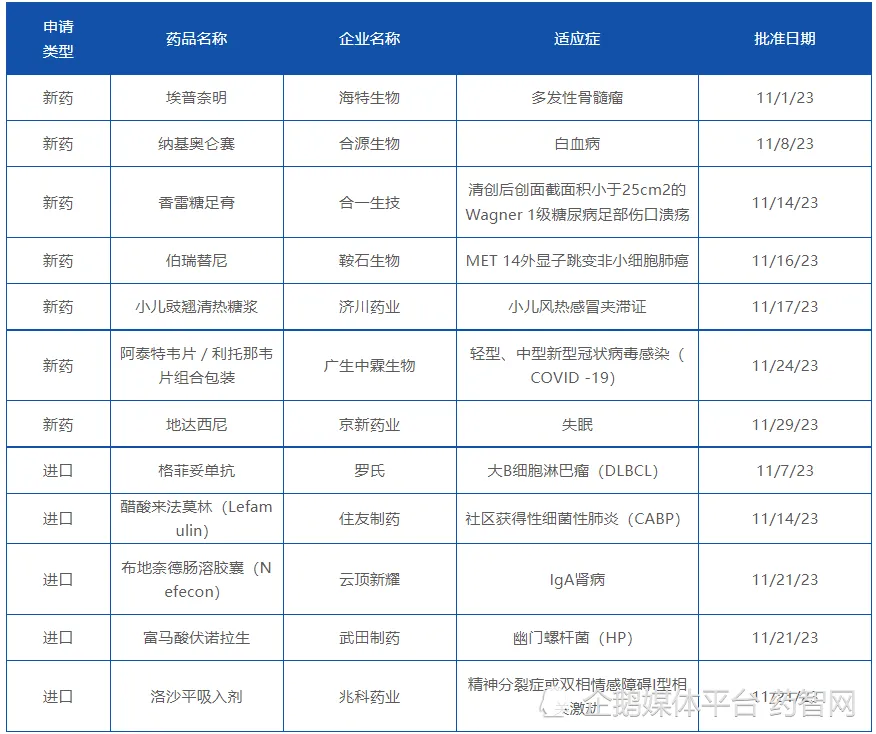
2023年11月,中国国家药品监督管理局(NMPA)批准了7个国产新药和5个进口新药,适应症涵盖多种肿瘤、肺炎、幽门螺杆菌感染、IgA肾病和精神疾病,详情见表2。
表2. 2023年11月NMPA批准的新药