锌元素的相对原子质量(锌原子的相对质量)
16;C12;N14;Na23;Cl35.5;S32:Fe56一、选择题(共17小题,每小题351分;每小题只有一个选项符....A.石墨B.氨水C.蔗糖D.烧碱某无色溶液中加入AgNO3溶液得白色沉淀,加稀硝酸沉淀不消失,则原液一定存在Cl或CO32某无色溶液中滴加BaCl2溶液得白色沉淀,加稀硝酸沉淀不溶解,则一定含有SO42不慎将浓硫酸沾到皮肤上,先用干布擦拭,再用大量水冲洗某无色溶液中滴加BaCl2溶液得白色沉淀,若加入盐酸则生成无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定有CO325.分类法在化学学科的发展中起到了非常重要的作用,下列分类标准合理44A.Ba(OH)2溶液和H2SO4溶液的反应B.Ba(OH)2溶液和CuSO4溶液的反应C.BaCl2溶液和H2SO4溶液的反应D.Ba(OH)2溶液和稀NaHSO4的反应7.欲配制100mL1.0mol/LNa2SO4溶液,正确的方法是Na2SO4溶于100mL水中Na2SO410H2O溶于少量水中,再用水稀释至100mL将20mL5.0mol/LNa2SO4溶液用水稀释至100mL28.4gNa2SO410H2O溶于少量水中,再用水稀释至200mL8.准确称取一块铁铝合金加入足量稀硫酸中,完全溶解后再加入过量氢氧化钠溶液并搅拌,过滤、洗涤、干燥,灼烧至恒重,冷却后称其质量发现与原来相同。
则合金中铝的质量分数约为(9.某溶液中大量存在以下浓度的五种离子:0.2mol/LCl、0.4mol/LSO42、3++10.在标准状况下6.72LCH43.0110HCl分子13.6gH2S0.2molNH3,下列对这四种气体的关系从大到小表达正确的是a.体积>>>b.密度>>>c.质量>>>d.氢原子个数>>>A.abcdB.bcdC.abcD.acd11.一定浓度的下列溶液,加入少量的固体NaOH后,溶液的导电能力变化不大的是(A.蒸馏水B.醋酸C.盐酸D.稀氨水唐河美丽夜景中的光柱用明矾净水水泥厂静电除卤水点豆腐一支钢笔使用不同牌号的蓝黑墨水易出现堵塞.13.将金属钠投入AlCl3溶液中,下列有关叙述一定正确C.一定有气体放出D.一定无气体放出pH=11的溶液中:CO32-、Na+、ClO-、NO3-加入Fe能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+B.NaHCO3溶液与NaOH溶液反应OH-=H2O4Fe(OH)2+O2+2H2O=4Fe(OH)3二、填空题(共4小题,4517.三农问题是政府和社会关注的问题,化肥是土地的营养品.某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;每次取1.00g此化肥样品,溶于20mL蒸馏水中;加入30.00mL1.00mol/LNaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;(1)写出步骤中的实验内容,写出实验步骤中的离子方程式:A.玻璃棒B.托盘天平C.烧杯D.漏斗(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/LNaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为A.50mL,50mLB.150mL,100mLC.100mL,150mLD.250mL,500mL(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式18.(1)写出Fe2(SO4)3在水溶液中的电离方程式:(2)写出下列离子方程式对应的一个化学方程式:2H++CO32-=H2O+CO2(3)用“双线桥法”标明电子转移的方向和数目.该反应中氧化剂与还原剂物质的量之比为该反应的离子方程式为(1)铝与氢氧化钠反应的离子方程式是此反应的氧化剂(2)铝与盐酸溶液反应的化学反应方程式是此反应的氧21.某镁铝合金7.5g和足量0.1mol/LHCl反应时放出5.6L气体,试求(1)合金中Mg的含量(用质量百分数表示)?(2)5g该合金溶于0.2mol/LNaOH溶液时消耗溶液的体0719相对原子质量与物质的量篇21.相对原子质量的定义:以一个碳12C原子质量的1/12为标准,任何一个原子的真实质量和一个12C原子质量的1/12的比值,称为该原子的相对原子质量。
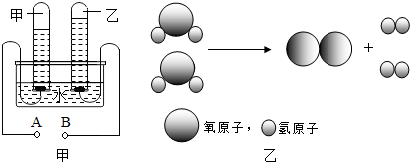
A.48gO3气体含有6.021023个O3分子B.常温常压下,4.6gNO2气体含有1.811023-+C.0.5molL1CuCl2溶液中含有3.011023个Cu2D.标准状况下,33.6LH2O含有9.031023个H2O分子A.2mol重水含有NA个D2O分子B.1氢气含有NA个H2分子C.2mol钠与过量稀盐酸反应生成NA个H2分子D.22.4水含有NA个H2O分子C.气体摩尔体积是指1mol任何气体所占的体积为D.不同的气体,若体积不等,则它们所含的分子数一定不等4.设NA为阿伏加德罗常数,下列叙述正确的是一氧化碳和二氧化碳的混合气体中含碳原子数为NAD2O所含质子数为12NAD.0.5mol铜与足量硫粉共热转移电子数为NA4.6gRb与另外一种碱金属混合物与H2O充分反应,放出氢气2.24L(STP),求两种碱金属的质量比。(提示:用平均数的特点)1.已知一个N203分子质量为akg,一个N205分子质量为kg,若以16O质量的1/16为相对原子质量标准,则N02的相对分子质量为A.物质的量就是物质的质量B.物质的量就是物质的摩尔质量C.物质的量是一种基本物理量D.物质的量就是物质所含微粒数目的多少钠与金属杂质2.3g与足量的盐酸反应,放出氢气0.09g,10则这种金属不可能是B.AlC.MgD.CuA.1mol物质中含有6.021023个微粒B.96g氧的物质的量为3molC.摩尔是7个基本物理量之—D.1mol氢氧化钠的质量为40g5.已知一个N203分子质量为akg,一个N205分子质量为kg,若以16O质量的1/16为相对原子质量标准,则N02的相对分子质量为6.CO2、H2O(g)混合气11.6g与足量的过氧化钠反应,过氧化钠增重3.6g,求混合气中CO2、和H2O(g)的比。
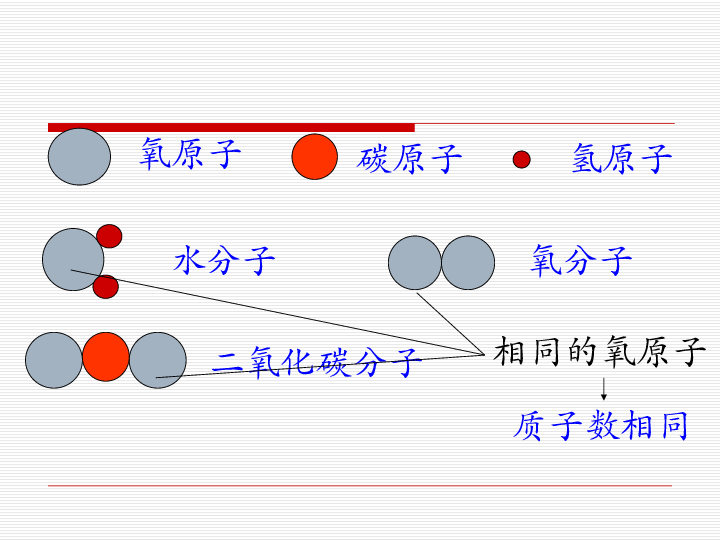
(可求出平衡摩尔质量)1000g溶剂中所含溶质的物质的量来表示溶液浓度叫质量摩尔浓度,其单位是mol/kg,5mol/kg的硫酸溶液的密度为1.29g/mol,则它的物质的量浓度为?A.3.34mol/LB.4.33mol/LC.1.17mol/LD.1.84mol/LHCL气体溶于1水中(假设此时水的密度为1g/mL),得到的密度为ρg/mL的盐酸,则它的物质的11量浓度为?CO2、H2、CO组成的混合气体在同温同压下与氮气 的密度相同,则该混合气体中CO2、H2、CO的体积比为? A.29:8:13B.22:1:14 C.13:5:29 D.26:16:57

