补硒肺癌几率(肺癌患者补硒有什么好处有用吗)
【摘要】恶性肿瘤患者常合并血脂异常,血脂异常既与恶性肿瘤疾病有关,又与疾病治疗有关。中国抗癌协会整合肿瘤心脏病学分会专家组总结了恶性肿瘤患者血脂异常的发生率和特征,汇总了常见抗肿瘤药物血脂异常的特点和发生机制,对抗肿瘤药物进行血脂异常危险分层,并制定血脂异常治疗及监测原则。专家参考国内外研究进展,结合中国临床经验制定了相应的血脂异常防治指引,旨在为临床医师提供切实可行的恶性肿瘤血脂管理策略,推进中国恶性肿瘤血脂异常的管理。
脂类是三大营养物质之一,脂类除能量供应及能量储存外,还发挥着重要的作用:(1)脂类是细胞的主要构成元素之一,细胞膜的主要成分包括磷脂(甘油磷脂和鞘磷脂)、胆固醇,脂类代谢的改变会直接影响细胞膜的合成,进而影响细胞的增殖;(2)脂类是细胞生命活动中的关键活性分子之一。多种脂类分子直接或间接参与各类细胞信号转导、炎症和血管的调节过程。脂类代谢异常不仅与心血管疾病发生密切相关,还与肿瘤发生、发展、侵袭和转移等密切相关。肿瘤细胞脂类代谢异常表现为不受控的脂肪酸从头合成及脂类合成增强,为肿瘤细胞持续增殖提供相应的微环境。肿瘤宿主的脂类代谢相对复杂,在脂类代谢合成异常的同时,可存在不同程度的外源性脂类利用障碍,从而诱发肿瘤患者血脂异常。 由于国内外目前尚无针对肿瘤患者血脂异常规范化诊断的指引,鉴于此,中国抗癌协会整合肿瘤心脏病学分会启动《恶性肿瘤患者血脂管理中国专家共识》的撰写,为肿瘤临床工作者提供相应的血脂管理规范化指引,有效地降低肿瘤患者血脂异常相关性心血管疾病的发生风险,改善肿瘤患者的心血管疾病状况。
一、肿瘤患者血脂异常的流行病学
肿瘤患者常合并其他疾病,约55%的肿瘤患者至少合并1种其他疾病,而心血管疾病是最常见的合并症之一。高脂血症是动脉粥样硬化性心脏病的重要危险因素,恶性肿瘤患者尤其是老年肿瘤患者,常合并高脂血症,且肿瘤相关治疗亦可影响血脂代谢,诱发或加重血脂异常,进一步增加肿瘤患者的心血管事件风险。
(一)
肿瘤患者合并血脂异常的流行病学
循证医学研究提示,高血脂可能促进恶性肿瘤的发生与发展,如乳腺癌、卵巢癌、子宫内膜癌等。由于肿瘤本身因素可导致肿瘤患者体内物质代谢发生明显改变,肿瘤患者脂类代谢的主要改变为脂肪组织分解动员增强、外源脂类利用下降、血浆脂蛋白乳糜微粒、极低密度脂蛋白(very low density lipoproteins, VLDL)和甘油三酯(triglyceride, TG)升高。因此,肿瘤患者常合并血脂异常,如不及时纠正血脂异常,长期脂类代谢异常会诱发肿瘤患者储存脂肪耗竭,严重时可发生骨骼肌蛋白分解,从而使肿瘤患者发生整体性消瘦,体重逐渐下降,严重者甚至可诱发或加重肿瘤恶液质,因此,脂类代谢异常是恶液质的重要相关因素之一。纠正肿瘤患者异常血脂可在一定程度上缓解恶液质的出现,有利于肿瘤疾病的预后。
1.高胆固醇饮食与肿瘤发生的流行病学 :脂质代谢在肿瘤组织中异常活跃,是恶性肿瘤新陈代谢的标志之一,而高胆固醇摄取与肿瘤的出现有明显的关联性。有研究显示,不同水平胆固醇的摄入会影响肿瘤发生的风险,饮食中高胆固醇的摄入可能增加食道癌的风险(OR=1.424,95% CI:1.191~1.704),按疾病类型进行亚组分析,饮食中胆固醇的摄入量与食管腺癌和食管鳞状细胞癌的发生有明显相关性。此外,高胆固醇的摄入亦会增加胰腺癌(每天摄入100 mg胆固醇,胰腺癌风险增加8%)和卵巢癌(每天摄入50 mg胆固醇,卵巢癌风险增加1%)的发生风险。但对乳腺癌,饮食中的胆固醇与乳腺癌之间为非线性关系,当胆固醇摄入量>370 mg/d时,增加乳腺癌的发病率。
2.血脂异常与肿瘤发生的流行病学: 胆固醇在肿瘤细胞的增殖、侵袭和耐药中也起着至关重要的作用。肿瘤组织和癌细胞中胆固醇的含量和组成与正常组织不同,胆固醇的氧化产物[如22(R)-HC、25-HC、27-HC和6-氧代-3β-胆甾醇]可以通过调控糖皮质激素受体、雌激素受体来促进或抑制肿瘤的进展。与非肿瘤细胞比较,肿瘤细胞可产生更多的促癌氧化胆固醇和更少的抑癌氧化胆固醇。血脂异常可为癌细胞提供更多的胆固醇,诱发癌细胞产生更多的促癌氧化胆固醇,从而增加肿瘤的发生风险。 OFFSPRING研究纳入3 278名成年人,高极低密度脂蛋白胆固醇(very low density lipoprotein cholesterol, VLDL-c)血症和低高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-c)人群的恶性肿瘤风险更高。一项韩国大型前瞻性研究结果显示,男性合并高胆固醇血症(≥240 mg/L)可明显增加前列腺癌和结肠癌的发病率,而女性则相反,胆固醇
(二)
肿瘤治疗引起血脂异常的流行病学
除了肿瘤疾病本身可引起血脂异常,抗肿瘤治疗可引起血脂异常,从而增加心血管事件的发生,并且心血管事件死亡逐渐成为肿瘤患者的主要死亡原因。 在乳腺癌治疗中,BIG1-98试验纳入8 010例激素受体阳性绝经后早期乳腺癌患者,结果显示,来曲唑组和他莫昔芬组患者治疗期间出现至少1次高脂血症的发生率分别为43.6%和19.2%。BIG1-98试验评估了来曲唑与他莫昔芬心血管事件的发生率,对8 010例女性进行了心血管事件随访,随访25.8个月时,来曲唑组与他莫昔芬组患者的心血管事件(致死性心肌梗死、Q波心肌梗死、非Q波心肌梗死、不稳定型心绞痛或需要血运重建的严重心绞痛)的发生率分别为4.1%(162/3 975)和3.8%(153/3 988);随访12.6年时,来曲唑组与他莫昔芬组患者心梗的发生率分别为3.9/1 000(人·年)、3.4/1 000(人·年),来曲唑组与他莫昔芬组患者其他心血管事件(原发性高血压、心律失常、致死性心肌梗死或需要血运重建的心绞痛)的发生率分别为8.4/1 000(人·年)和3.0/1 000(人·年)。 在前列腺治疗中,一项研究纳入3项前瞻性多中心临床试验(149-98-02、149-98-03、149-9903),共入组1 102前列腺癌患者,研究者研究阿巴瑞克、亮丙瑞林、亮丙瑞林+比卡鲁胺三组对血脂的影响,治疗85 d后,与基线相比,阿巴瑞克组患者TG、TC、HDL-c、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-c)水平分别较基线上升52%、20%、15%和2%(P
二、肿瘤患者血脂异常相关心血管疾病的危险因素
1.普通人群共有危险因素: 血脂异常并非肿瘤患者特有,而是普通人群普遍存在的常见疾病之一,普通人群血脂异常主要的共有因素包括:(1)高血压;(2)糖尿病;(3)肥胖:体质量指数≥28 kg/m2;(4)吸烟;(5)年龄:女性≥55岁,男性≥45岁;(6)不良饮食习惯;(7)遗传因素:家族性高脂血症者;(8)冠心病或其他心血管事件疾病家族史:尤其是直系亲属中有早发冠心病或其他心血管事件疾病者(男性一级亲属发病年龄
2.肿瘤治疗相关危险因素: 肿瘤治疗可引起高脂血脂,常见的因素包括:化疗药物,内分泌治疗药物,靶向药物,免疫治疗,放疗等,其详细临床研究、影响血脂的机制及血脂异常危险分层具体汇总见表1。

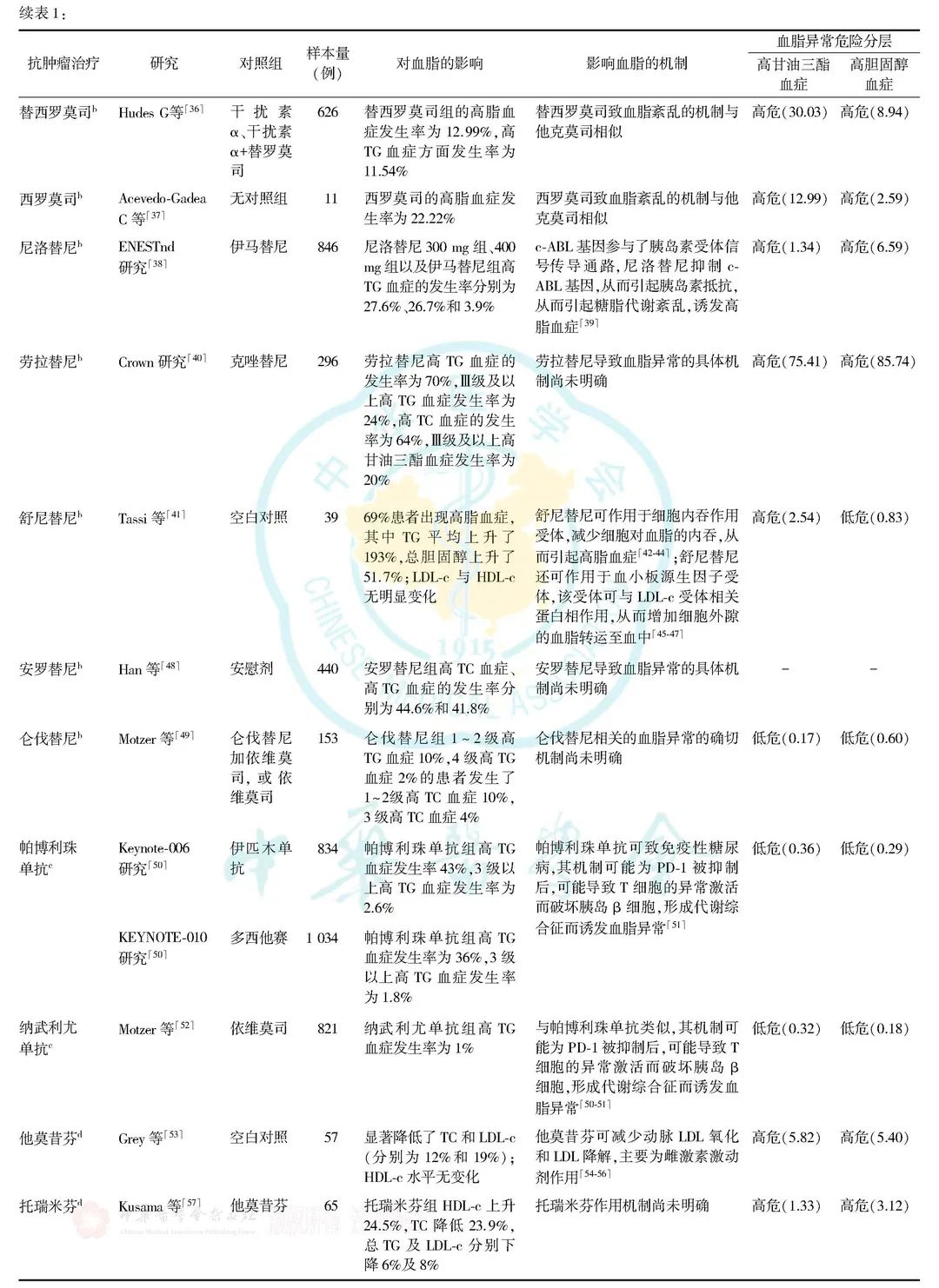
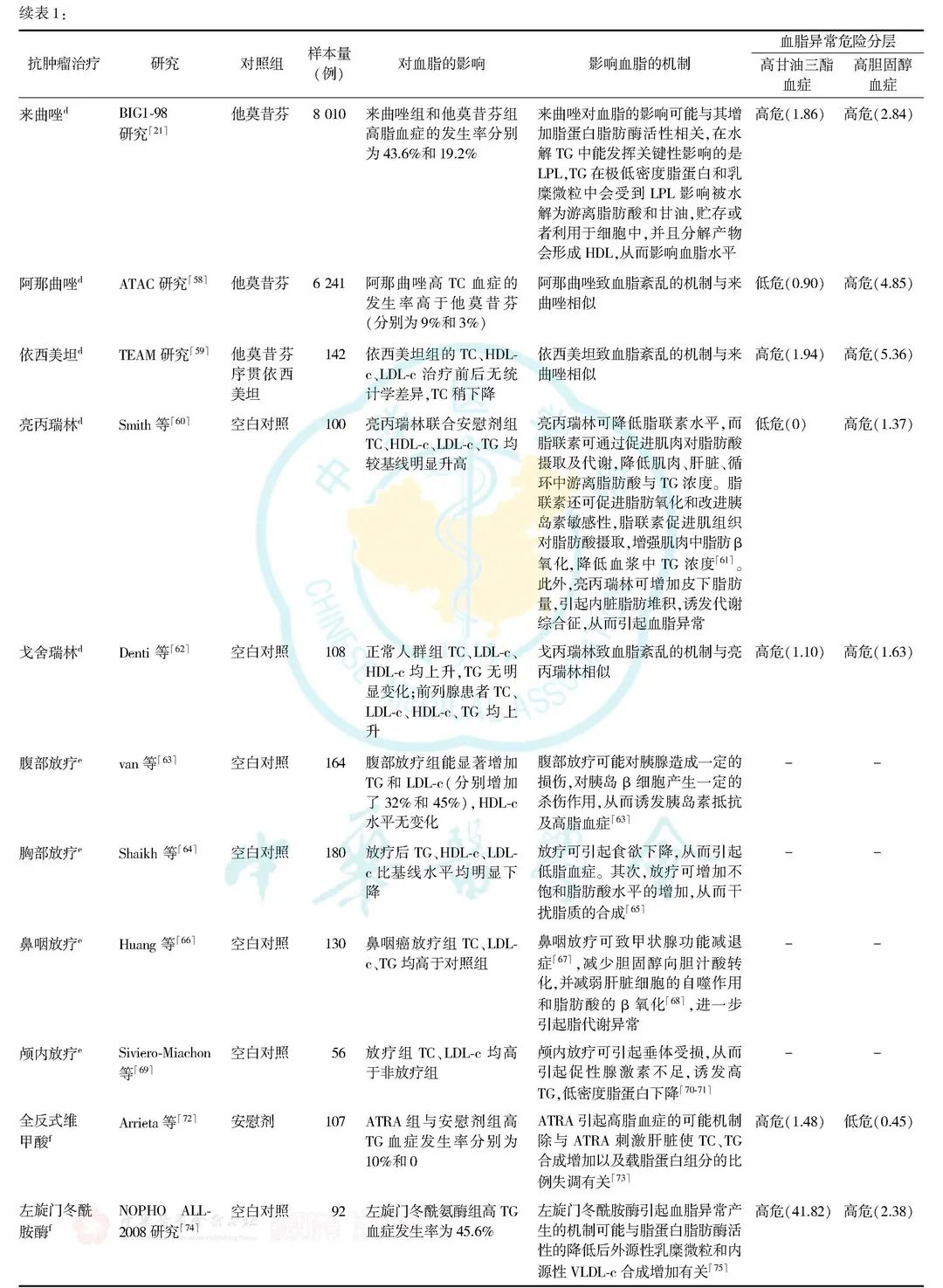

三、肿瘤患者血脂异常的治疗指引
(一)
肿瘤患者血脂异常主要控制靶标
LDL-c或非HDL-c水平对个体或群体动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease, ASCVD)发病危险具有独立的预测作用,但由于国内外目前尚未有针对肿瘤患者血脂控制的指南与规范,本共识结合现有临床研究数据,将肿瘤患者血脂异常的主要控制靶标列为LDL-c,次要靶标列为非HDL-c。
(二)
ASCVD危险分层
肿瘤患者血脂异常的主要危害是增加心血管事件的发生概率,参照中国成人血脂异常防治指南(2016年修订版),将肿瘤患者ASCVD分为极高危、高危、中危和低危4个分层。不同血脂水平中国人群ASCVD发病危险的长期观察性研究结果表明,血脂异常患者发生ASCVD风险的高低不仅取决于LDL-c或非HDL-c水平的高低,同时亦取决于患者伴随ASCVD危险因素的数量及水平。对血脂异常肿瘤患者进行ASCVD发病危险评估,有利于更早期识别高危ASCVD的肿瘤患者。肿瘤患者ASCVD的血脂分层标准具体为(具体评估流程见图1):(1)极高危人群:已诊断为ASCVD的人群。(2)高危人群:LDL-c≥4.9 mmol/L;TC≥7.2 mmol/L;LDL-c水平为1.8~4.9 mmol/L且年龄为≥40岁的糖尿病患者;TC水平为3.1~7.2 mmol/L且年龄为≥40岁的糖尿病患者;ASCVD事件10年发病危险≥10%;年龄
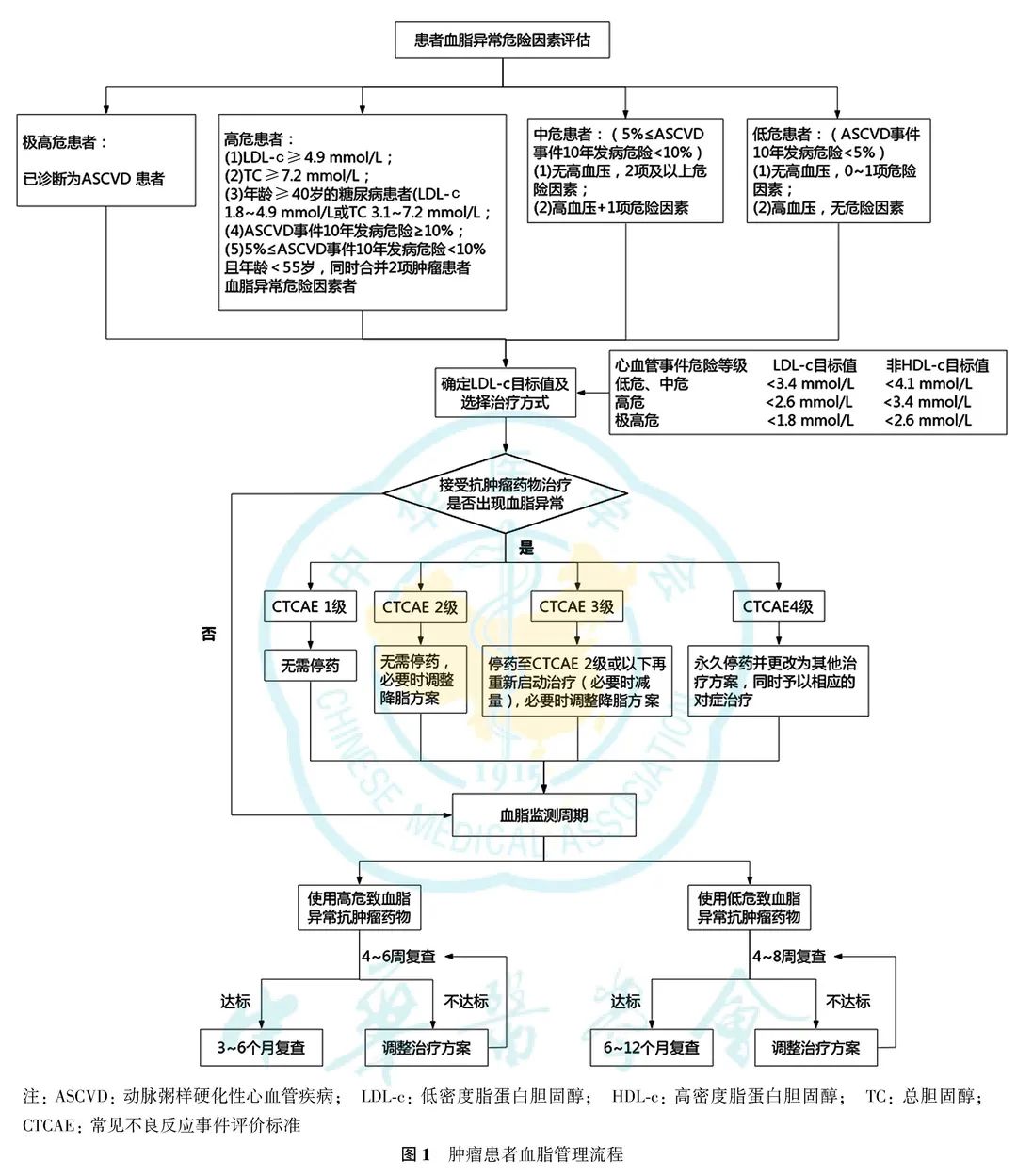
(三)
LDL-c控制目标
根据肿瘤患者ASCVD危险分层而定,极高危险患者LDL-c应控制在1.8 mmol/L以下,高危患者LDL-c应控制在2.6 mmol/L以下,中、低危患者LDL-c应控制在3.4 mmol/L以下。由于他汀类药物降脂幅度与剂量无线性关系,翻倍剂量的他汀并不能带来翻倍的降脂效果,如LDL-c基线水平较高的肿瘤患者使用降脂药物标准治疗3个月,LDL-c仍未能达到LDL-c控制目标值,则应将LDL-c控制目标值调整为LDL-c至少降低50%。少数极高危患者的LDL-c基线水平在降脂治疗前目标范围内,则应将LDL-c控制目标值调整为LDL-c基线值降低30%。
(四)
抗肿瘤药物血脂异常的危险分层
目前,国内外均尚未见抗肿瘤药物血脂异常危险分层标准,本指引首先参考了抗肿瘤药物临床研究中血脂异常的临床研究情况,还参考真实世界抗肿瘤药物血脂异常数据,而真实世界数据引用美囯食品药品监督管理局药物不良反应上报数据库,应用报告比值比法(reporting odds ration, ROR)挖掘抗肿瘤药物血脂异常的药品不良反应信号值,ROR数值95%置信区间下限值ROR025>1时,提示相关抗肿瘤药物血脂异常不良事件存在相关危险信号。本共识根据ROR025值的大小,将抗肿瘤药物引起血脂异常分为高危(ROR025>1)、低危(ROR025≤1)。替西罗莫司、西罗莫司、劳拉替尼、左旋门冬酰胺酶的ROR025均>10,其血脂异常风险尤为高,使用时应特别警惕。本共识未纳入的其他抗肿瘤药物,由于其血脂异常的相关临床研究证据较少,暂均列为低风险血脂异常抗肿瘤药物。
(五)
肿瘤患者血脂异常的非药物干预
主要为生活方式干预,包括戒烟、保持理想体质量或减重、运动、调整饮食结构。(1)戒烟:不吸烟、避免吸二手烟,同时可行戒烟药物治疗或使用尼古丁替代。(2)保持理想体质量或减重:通过运动、控制饮食及行为训练维持或减轻体质量,保持体质指数≥20 kg/m2且≤24 kg/m2,腰围
(六)
肿瘤患者血脂异常的药物干预
具有充足循证医学证据的肿瘤患者血脂异常治疗药物为羟甲基戊二酰辅酶A(hydroxy methylglutaryl coenzyme A, HMG-CoA)还原酶抑制剂(他汀类),其他的调脂药物如苯氧芳酸类(贝特类)、肠道胆固醇吸收抑制剂等目前循证医学证据尚不充分。如果生活方式调节仍未能使血脂达标的患者,则需要启动调脂药物治疗。调脂药物主要包括HMG-CoA还原酶抑制剂(他汀类)、苯氧芳酸类(贝特类)、烟酸类、胆酸螯合剂(树脂类)、肠道胆固醇吸收抑制剂、前蛋白转化酶枯草杆菌蛋白酶/kexin9型等。
1.他汀类药物治疗: 他汀类药物的作用机制为选择性竞争性抑制HMG-CoA还原酶,同时反馈性增加肝脏细胞膜表面低密度脂蛋白(low density lipoprotein, LDL)受体的数量,使血清胆固醇清除增加,降低血脂水平。循证医学证据表明,他汀类药物不仅可以改善心血管疾病的预后,还能改善乳腺癌患者的全因死亡率。一项荟萃分析结果显示,他汀类药物的使用可以降低乳腺癌患者的全因死亡率,尤其是脂溶性他汀类药物可明显改善死亡率(HR=0.57,95% CI:0.46~0.70),但该结论仍需大规模的前瞻性研究证实该结论,由于脂溶性他汀类药物为优选药物仍未被充分证实,因此,本共识推荐脂溶性、水溶性他汀类药物均可作为肿瘤患者血脂异常的治疗药物。他汀的初始给药剂量应根据患者血脂目标选择而定,常规推荐中等强度的他汀作为肿瘤患者血脂异常的初始给药剂量,如瑞舒伐他汀5~10 mg,阿托伐他汀10~20 mg,辛伐他汀20~40 mg,氟伐他汀80 mg,匹伐他汀2~4 mg,普伐他汀40 mg,洛伐他汀40 mg。
2.贝特类药物治疗: 贝特类药物可激活过氧化物酶增殖体激活受体,诱导脂蛋白酯酶表达,促进富含甘油三酯的脂蛋白颗粒中甘油三酯水解,同时促进肝脏摄取脂肪酸和抑制肝脏合成TG,从而降低TG水平。有研究显示,与安慰剂组比较,高TG伴低HDL-c人群非诺贝特组的心血管事件HR为0.91,但对于总体死亡率差异无统计学意义。临床常用的贝特类调脂药物的用法用量为非诺贝特0.1 g/次,3次/d或缓释胶囊0.2 g/次,1次/d;吉非罗齐0.3~0.6 g/次,2次/d;苯扎贝特0.2~0.4 g/次,3次/d。
3.胆固醇吸收抑制剂: 依折麦布的主要作用靶点为甾醇甾体,依折麦布通过附着在小肠绒毛上皮的刷状缘,选择性抑制小肠胆固醇转动蛋白,从而抑制胆固醇的吸收,最终降低血浆胆固醇水平。在他汀类药物治疗基础上加用烟酸、贝特类药物都未能产生额外的临床获益,但是,在 IMPROVE-IT试验中,依折麦布与辛伐他汀联合治疗却可使患者心血管死亡、心肌梗死和卒中发生率下降2%,此外,两组间恶性肿瘤、肌肉和胆囊相关事件发生率无明显差异,证实了依折麦布与瑞舒伐他汀联合治疗的安全性。依折麦布常规用法用量为10 mg/次,1次/d,其常见不良反应为头疼与消化道反应,与他汀联用时可发生肌痛与转氨酶增高等不良反应。
4.降脂药物联用原则: 一般情况下,不推荐他汀类药物常规与其他降脂类药物联合使用,他汀类作为肝药酶P450的底物,常可与其他降脂药物发生相互作用,从而可显著增加他汀药物的肝损风险及肌肉不良反应。当肿瘤血脂异常患者使用他汀类药物降脂后血脂水平仍未达标,可考虑他汀类药物联合依折麦布、贝特类或烟酸类药物。但由于吉非贝齐无降低LDL-c的效果,与他汀类联合使用可能增加横纹肌溶解或肌病的并发症,二者应尽量避免联合使用。患者因不良反应无法耐受他汀类药物时,可考虑换用其他降脂药物治疗。
(七)
肿瘤患者血脂监测周期
不同抗肿瘤药物致血脂异常风险不同,因此,对于高危血脂异常药物的监测周期较低危血脂异常药物监测周期短,具体如下。
1.高危血脂异常抗肿瘤药物: 初始监测周期为4~6周,给予降脂药物后4~6周复查血脂、肝功能、肌酸激酶,若无特殊情况,且血脂水平达标,则监测周期可延长为3~6个月复查1次,连续达标者可每年复查1次。
2.低危血脂异常抗肿瘤药物: 初始监测周期为4~8周,给予降脂药物后4~8周复查血脂、肝功能、肌酸激酶,若无特殊情况,且血脂水平达标,则监测周期可延长为6~12个月复查1次,连续达标者可每年复查1次。
3.血脂未达标后监测周期的调整: 如血脂水平未能达标,则需要调整降脂治疗方案,可增加降脂药物剂量或更换其他降脂药物,必要时可采用不同作用机制的降脂药物联用降脂方案进行治疗,在调整治疗方案后4~6周复查血脂、肝功能、肌酸激酶。根据患者血脂水平是否达标,后续监测周期同前所述。
四、结语
规范管理恶性肿瘤患者血脂异常,有助于提高患者的预后,中国抗癌协会整合肿瘤心脏病学分会专家组制定本共识有助于临床医师加强恶性肿瘤患者的血脂管理,有助于临床医师甄别常见抗肿瘤药物引起血脂异常,确保患者在肿瘤治疗时血脂得到较好地管理,并通过多学科会诊讨论的模式调脂方案与抗肿瘤治疗方案的用药安全,兼顾化疗疗效与调脂疗效。
引用本文
中国抗癌协会整合肿瘤心脏病学分会专家组. 恶性肿瘤患者血脂管理中国专家共识[J]. 中华肿瘤杂志, 2021, 43(10):1043-1053.DOI: 10.3760/112-00321

