补硒对抗炎症(补硒对抗炎症)
单位:中国医学科学院北京协和医学院北京协和医院心内科疑难重症与罕见病国家重点实验室中国医学科学院北京协和医学院国家心血管病中心阜外医院病理科
摘要
心肌炎和炎症性心肌病是导致心力衰竭的常见疾病,也是心血管系统疾病中的难点。多种炎症细胞在心肌损伤、修复和重塑过程中发挥着重要作用,影响到炎症性心肌病的预后。但目前对于该类疾病的认识,特别是早期诊断、精准评估以及治疗管理尚不到位,尤其在心肌病理层面仍有不少尚未解决的问题。认识炎症性心肌病心肌组织损伤/修复机制,形成包括临床医师以及心肌病理学、心脏影像学和免疫学专家的心肌炎诊疗研究团队,建立诊断、治疗和随诊的完整系统,不断探索新的治疗方法,对提升心肌炎和炎症性心肌病早期诊断水平,改善患者预后意义重大。该文重点阐述了心肌炎和炎症性心肌病的病理生理学机制和常见的病理学表现,以期引起心血管专科医师对该领域的重视。
正文
心肌炎是指由非缺血性病因引起的心肌炎症性病变,其组织学改变为炎症细胞在心肌间质内浸润,伴有心肌细胞变性和坏死,需要通过组织病理学、免疫学和免疫组织化学确诊 [ 1] 。世界卫生组织(WHO)/世界心脏病联盟(WHF)将组织病理学表现为心肌炎同时有心功能不全者定义为炎症性心肌病 [ 2] 。
因为心肌活检和心肌病理学检查以及心脏磁共振成像等技术手段尚未广泛开展,心肌炎的实际发病率尚不清楚,有研究推测心肌炎的全球发病率约为每年22/10万人 [ 3] ,但实际上心肌炎的发生率可能被严重低估。有报道显示在无法解释的心肌病中心肌炎症的发生率为9%~40%,高达50%的心律失常患者心肌有活动性炎症表现 [ 4] 。心肌炎患者的临床表现和预后差别很大,从轻微症状(如全身乏力、胸痛伴或不伴轻微的心脏功能障碍)至危及生命的心律失常和/或严重的心力衰竭(心衰) [ 5] 。 虽然心肌炎的发病率较高,且可能导致严重的后果,但临床上相关的诊疗措施尚不到位,多数医学中心均未形成心肌炎诊断、治疗和随访的完整体系,导致部分患者由心肌炎进展为炎症性心肌病,甚至造成心衰等严重的临床后果。虽然心内膜心肌活检是一种有创检查方法,但目前病理学诊断仍是医学界公认的心肌炎和炎症性心肌病诊断的金标准。持续的炎症状态可导致炎症性心肌病。早期识别心肌炎症状态是及时做出正确临床决策、防止致死性心律失常和心衰发生的关键,因此临床医师应高度重视心肌炎的病理诊断。
一、炎症性心肌病的病理生理学机制
引起心肌炎的病因多种多样,既包括感染性病原体如病毒、细菌、支原体、衣原体等,也包括非感染性因素如自身免疫性疾病、中毒、药物不良反应和高敏反应等 [ 6, 7, 8] 。如果引起心肌炎的病因未完全清除或清除后炎症反应持续存在,最终会发展为炎症性心肌病,如果未得到有效的治疗则会进展为心衰,认识损伤与修复之间复杂的病理生理学过程非常重要。
1.感染性心肌炎:病毒性心肌炎的病理生理学信息多数来自肠道病毒感染的鼠类模型,尤其是B3型柯萨奇病毒(CVB3)。心肌损伤主要包括病毒感染介导的直接损伤和继发性免疫应答引起的间接损伤。病毒进入心肌后会引发3种反应,急性期以病毒进入和复制为特征,亚急性期以炎性细胞浸润为特征,慢性期以心脏重塑为特征 [ 9] 。
首先病毒可直接导致心肌损伤。已有研究表明,CVB3感染足以在缺乏成熟T和B淋巴细胞的严重免疫缺陷小鼠中诱发心肌损伤 [ 10] 。病毒导致心肌细胞稳态丧失,翻译/转录关闭,收缩功能障碍和凋亡 [ 9] 。此阶段抗病毒治疗的效果尚有待证实。病毒引起的免疫损伤是心肌炎持续和进展的关键。病毒感染会激活宿主抗病毒免疫反应,主要会出现自然杀伤细胞和巨噬细胞以及特异性T淋巴细胞浸润 [ 9] 。免疫反应初始激活可限制病毒传播,但持续过度免疫反应则造成有害后果,导致炎症性心肌病。
感染早期,先天免疫反应会通过多种细胞因子抑制病毒复制,包括白细胞介素(IL)、肿瘤坏死因子-α和干扰素(IFN)等。在CVB3动物模型中,机体模式识别受体,包括Toll样受体(TLR)、视黄酸诱导型基因1样受体、核苷酸结合寡聚域样受体和C型凝集素受体等,可识别CVB3基因信息并触发细胞内信号传导级联反应,从而导致Ⅰ型IFN和促炎细胞因子生成。Ⅰ型IFN(IFN-α、IFN-β)是抑制CVB3复制的重要抗病毒介质 [ 9] 。如果调节不当,免疫反应的有益作用可能会转变为对心肌组织的损害。如病毒感染后持续产生促炎性细胞因子可加剧心肌损伤,导致心功能受损。此外,调节性T细胞(Treg)与产生IL-17的T细胞(Th17)之间的平衡在病毒性心肌炎的发生发展中起着重要的作用。Treg抑制促炎反应,而Th17则诱导免疫反应增强 [ 11] 。但是对于辅助性淋巴细胞在炎症性心肌病中的作用目前尚不十分清楚,如何采用有效调控方式改善预后和减少不良反应仍是摆在临床医师面前的一道难题。
适应性免疫反应始于心肌炎急性和亚急性期后,淋巴细胞浸润有助于清除感染病毒的心肌细胞,但也可能引起心肌损伤。早期鼠类研究表明T淋巴细胞的耗竭可降低死亡率,并减少CVB3感染后的心肌炎症反应和损伤。如果没有CD4 + 和CD8 + T淋巴细胞心肌炎症会减弱,且实验动物死亡率显著降低 [ 9, 12, 13] 。病毒感染后,心脏抗原(如与柯萨奇病毒抗原交叉反应的心肌肌球蛋白)暴露于免疫系统会诱发自身免疫反应,通过自身抗体和自身反应性免疫细胞导致心肌细胞损伤。此阶段需要关注的是微小RNA(miRNA)在修复阶段的作用。有研究表明miRNA在心脏病毒感染的不利炎症反应中也起了作用。据报道CVB3感染时miRNA-155表达水平明显升高,与浸润的炎症细胞并存于小鼠或患者心肌中,下调miRNA-155表达可减轻炎症浸润,改善小鼠或患者心功能、降低死亡率 [ 14] 。

心肌重塑过程中,病原体清除导致炎症级联反应下调。但在某些患者中,由于病原体未完全清除甚至清除后炎症反应仍持续存在,最终会导致慢性心肌炎、炎症性心肌病,甚至演变为扩张型心肌病。
2.非感染性心肌炎:炎症性心肌病也可通过非感染性免疫介导引起的心肌炎进展而来由于也可能与系统性疾病有关,如结节病、嗜酸性肉芽肿多血管炎(EGPA)、系统性红斑狼疮(SLE)、类风湿性关节炎/青少年特发性关节炎、硬皮病、肌炎和白塞病等。因此不同背景下,心脏受累程度、严重程度和部位的差异可能很大。自身免疫性心肌炎,CD4 + T淋巴细胞是主要作用因子 [ 15] ,但自身抗体也可直接攻击心肌组织引起损伤。自身炎症性疾病是由于基因突变导致编码蛋白发生改变,进而导致固有免疫失调从而引起全身性炎症反应,患者可能发生心衰,如累及传导系统可能会发生致命性心律失常。
二、心肌炎的病理学表现
心肌炎的基本病理学变化包括炎症细胞的浸润和心肌细胞的损伤。炎症细胞具有吞噬、免疫和组织损伤的作用,不同的炎症类型、炎症的不同阶段以及在机体不同的免疫状态下,浸润的炎症细胞种类不同。对心肌炎病灶中炎症细胞种类的识别,并判断其在心肌损伤不同阶段中的作用,对判断病因、评估预后以及制定治疗方案均具有重要意义。
2013年欧洲心脏病学会提出了心肌炎的组织病理学诊断标准——标本中出现≥14个淋巴细胞/mm 2 ,且CD3 + T淋巴细胞≥7个细胞/mm 2 [ 1] 。此标准在Dallas标准上增加了免疫组织化学的信息,为广大学术界所接受。但其仍缺乏对于一些重要的炎症细胞的识别,如巨噬细胞亚型、T细胞亚型等,这些细胞在炎症性心肌病的后续发展中起到了重要作用,有待于进一步深入研究。

在病理组织学层面,依据浸润炎症细胞的主要类型,心肌炎可分为淋巴细胞性心肌炎、嗜酸性粒细胞性心肌炎、巨细胞心肌炎、肉芽肿性心肌炎(如心脏结节病)及化脓心肌炎等 [ 16] 。
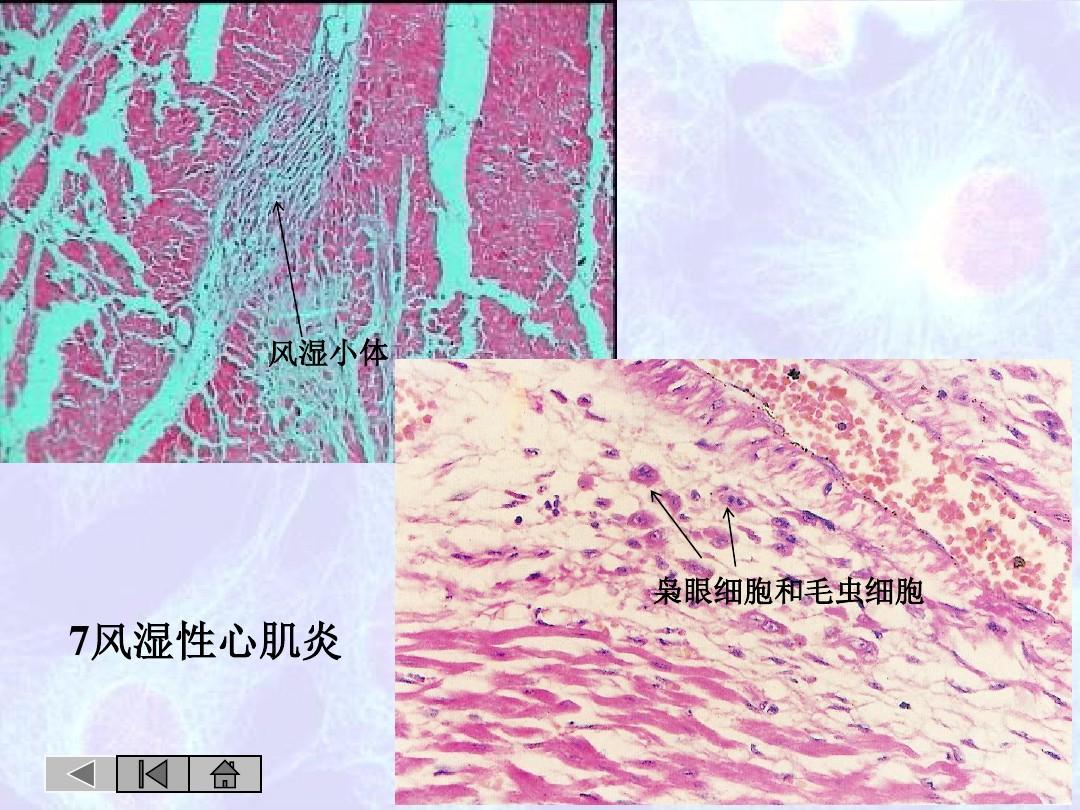
1.淋巴细胞性心肌炎(图1 A~D):淋巴细胞性心肌炎是最常见的组织学亚型,多见于病毒感染,此外一些自身免疫性疾病如SLE、肌炎和类风湿性关节炎累及心脏时也可见到此类心肌炎。其特征是浸润的炎症细胞主要为T淋巴细胞和巨噬细胞,可能会出现少量的中性粒细胞,也可见到少量的浆细胞和嗜酸性粒细胞。
病毒性心肌炎可分为急性期、恢复期、痊愈期和慢性期。急性期心肌局灶性或弥漫性病变,以心肌细胞损伤为特征,伴有大量炎症细胞浸润。恢复期心肌内急性炎症损伤减轻,纤维肉芽组织逐渐替代坏死、溶解的心肌细胞。痊愈期心肌内急性炎症病变完全消退,无异常改变或仅有轻度间质纤维化与局灶性纤维瘢痕。慢性期心肌内有反复或持续的心肌细胞炎性损伤,伴间质纤维化、心肌细胞变性、间质水肿与炎症细胞浸润等,可能由于病毒持续存在或病毒感染后诱发的免疫反应反复或持续性破坏心肌所致。持续的心肌慢性炎症往往导致炎症性心肌病。在疾病的早期进行心内膜心肌活检,有助于早发现、早诊断。而且对活检组织进行病毒病原学检查有助于针对性地治疗。治疗中或治疗后复查心内膜心肌活检,可以动态监测疾病状态,评估患者对治疗的反应。
2.巨细胞性心肌炎(图1E~G):巨细胞性心肌炎常进展迅速,临床多表现为严重心律失常、急性心功能不全、心原性休克甚至死亡。其组织学特点为含有多核巨细胞的混合性炎症病灶分布于心壁各层,病灶内伴有严重的心肌细胞损伤。浸润的炎症细胞除巨噬细胞来源的多核巨细胞外,还有淋巴细胞、巨噬细胞,并可见少量嗜酸性粒细胞和浆细胞。一般认为这种类型的心肌炎与自身免疫相关。通过心内膜心肌活检诊断此类心肌炎敏感度较高 [ 17] 。
3.心脏结节病:心脏结节病的病理学表现为非干酪样坏死性上皮样肉芽肿性炎。目前普遍认为,结节病的肉芽肿性炎是对一种持久性的、难以降解的、性质不确定的抗原的反应。过程包括局部辅助T细胞介导的免疫反应,复杂的淋巴细胞-巨噬细胞相互作用,骨髓来源的巨噬细胞迁移到抗原定位区域,并排列成上皮样肉芽肿结构。在肉芽肿形成过程中,巨噬细胞经历了以功能改变为特征的成熟过程,包括分泌能力增强、吞噬能力减弱以及形态改变,从而转化为上皮样细胞和多核巨细胞。多核巨型细胞内可见Schaumann小体和星型小体(asteroid bodies)。病变早期的组织学表现为非干酪样坏死性肉芽肿,周围有少量淋巴细胞浸润和轻度纤维化。肉芽肿附近的心肌细胞坏死与淋巴细胞浸润有关。随着疾病的进展,淋巴细胞减少,肉芽肿逐渐被不同程度纤维化的间质包裹。到了病变晚期,会出现大片硬化区和融合性肉芽肿。

4.其他肉芽肿性心肌炎:其他表现为肉芽肿性炎的心肌炎可能与感染或自身免疫病有关,其中感染包括结核、其他分枝杆菌感染、真菌感染、慢性Chagas病或其他寄生虫感染。肉芽肿的组织学特征(干酪样、坏死性、化脓性)有助于鉴别诊断。在病理切片上对抗酸杆菌、真菌和寄生虫等进行特殊染色有助于诊断,准确的病理学诊断有着不可替代的临床价值。
5.嗜酸性粒细胞性心肌炎(图1H):嗜酸性粒细胞性心肌炎较为罕见,与多种疾病相关,病因包括超敏反应(HSM)、免疫介导的疾病、特发性高嗜酸性粒细胞综合征、非血液系统恶性肿瘤、寄生虫感染和药物或者疫苗的使用等。共同点是嗜酸性粒细胞浸润,嗜酸性粒细胞可以是主要的炎症成分,也可与淋巴细胞、巨噬细胞、浆细胞形成微肉芽肿和巨细胞。Löffler心内膜心肌炎是嗜酸性粒细胞性心肌炎中最常见的类型,表现为心内膜嗜酸性粒细胞浸润、心内膜纤维增生和内膜下心肌坏死。除了Löffler心内膜炎还有2种最常见的形式,即药物相关的HSM和EGPA心肌炎。HSM是对药物的迟发性过敏反应,为剂量依赖性,通常病因消失后可逆。嗜酸性粒细胞性心肌炎中最为严重的是坏死性嗜酸性心肌炎,组织学特点是广泛的心肌坏死和弥漫性间质性炎症,主要由嗜酸性粒细胞、巨噬细胞、散在的淋巴细胞和浆细胞组成。
6.化脓性心肌炎:化脓性心肌炎是一种罕见的细菌性心肌炎,通常出现在免疫功能低下的病患中,病原菌为化脓性细菌,如葡萄球菌、链球菌、肺炎双球菌、脑膜炎双球菌等,多数来自于血行感染。组织学可见心肌坏死、微脓肿形成和以中性粒细胞为主的炎症细胞浸润。中性粒细胞可以聚集在微脓肿中或在心肌细胞周围散布。晚期被化脓灶钙化、纤维包裹或纤维瘢痕替代。
7.淋巴-组织细胞性心肌炎:某些形式的心肌炎表现出淋巴细胞-组织细胞学病理模式,淋巴细胞和巨噬细胞均存在,但后者比淋巴细胞更为重要,这种病理学改变可能提示淋巴细胞性心肌炎处于修复期。实际上,近年来已有文献提示M1型单核巨噬细胞可在心肌中长期存在,与扩张型心肌病的预后不良有关 [ 18] 。临床需深入研究此类心肌炎,可能解释很多不明原因心衰。
8.心肌炎伴血管炎和微血管炎症:此类心肌炎多见于系统性疾病如SLE、类风湿关节炎、结节性多动脉炎和EGPA,血管炎活动期经常会伴有心肌炎。此类心肌炎中可观察到以内皮细胞肿胀和血管内单核细胞为特征的微血管炎症,提示存在抗体介导的排斥反应,可能有助于阐明某些形式的心肌血管炎潜在的免疫机制。
三、分子病理学
当前分子诊断方案建议检查以下病毒:肠病毒、腺病毒(尤其是儿童)、巨细胞病毒、EBV病毒、单纯疱疹病毒1和2、人疱疹病毒6、细小病毒B19、甲型和乙型流感病毒,如果是丙型肝炎患者,还建议检查丙肝病毒 [ 19, 20, 21, 22, 23] 。但在心肌组织中鉴定出某种病毒基因组并不意味着该病毒一定是心肌炎的病原体,阴性PCR也不能排除病毒性疾病。在心肌活检组织和外周血中进行病毒载量的定量评估,对于评估全身感染至关重要。要识别导致心肌炎症的病因,不仅需要寻求真实的病毒基因数据,还应该判断在诸多因素中谁才是导致炎症的真正原因。
目前病原学,特别是病毒,已成为研究启动心肌炎始发因素的热点,实际上过去关于心肌炎的病原学研究限于技术手段,尚未深入开展,临床需要与分子病理学和病毒专家一起合作方能进一步打开局面。
四、展望
目前有很多先进的方法可以对心肌炎症进行更为深入的探究,如电镜、采用更广泛的抗体进行免疫组织化学检查等。但心肌炎症是一个动态过程,心肌炎症的不同时期病理生理学和病理学表现都在动态演变,可能基于蛋白组和转录组学的心肌活检标本分析会成为炎症性心肌病的重要研究手段,转录组学可以帮助识别组织学上不可见的炎症分子指纹,识别非常早期的心肌炎症,提供病因学信息。分子标记可以识别与个别基因、mRNA转录本和蛋白质相关的特定表型,这对考察心肌炎不同时期的心肌病理变化意义重大 [ 24, 25] 。因此心肌活检的目标也在逐渐发生变化,过去是为了病理形态学诊断,未来可能更重要的是分子分型和分子病理学诊断。另外,心肌炎患者的肠道微生物即宏基因组学的研究也备受关注,特别是肠道病毒相关的心肌炎和心肌病,亟待更多临床医学中心参与。
总之,心肌炎和炎症性心肌病是长期未得到足够重视的心血管系统的重要疾病,深入认识此类疾病的病理学表现,对于精准诊断并制定合理的治疗策略非常重要。但目前我国心内膜心肌活检开展有限,甚至对心内膜心肌活检有错误认识,导致该领域进展缓慢。感染性和非感染性病因导致心肌炎症,多种不同类型的细胞在心肌损伤、免疫介导和修复重塑中均起到了不同的作用。深刻认识到这些损伤/修复机制,组建包括临床医师、心血管病理和微生物、免疫学专家的心肌炎诊疗团队,建立诊断、治疗和随诊的完整体系,对于提高心肌炎和炎症性心肌病的诊治水平、改善患者预后至关重要。此外,构建高标准的有关心肌炎患者心肌组织、血液、肠道微生物等组织标本库,利用最新的组学技术在免疫反应过程中寻找新的干预靶点,努力开发针对心肌炎的生物靶向药物,是该领域研究的主要方向。
利益冲突所有作者均声明不存在利益冲突

